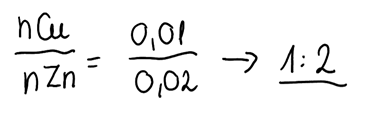1. Zapisujemy równania reakcji składników stopu z kwasem solnym. Miedź nie reaguje z tymże kwasem, ponieważ ma potencjał wyższy od wodoru, zatem wszelkie obliczenia będą odbywać się dla reakcji kwasu solnego z cynkiem. Należy pamiętać, że 1 mol gazu w warunkach normalnych zajmuje objętość 22,4 dm3 i obliczyć masę cynku w stopie. Znając ją oraz masę całego stopu można obliczyć także masę miedzi, która nie przereagowała z HCl:
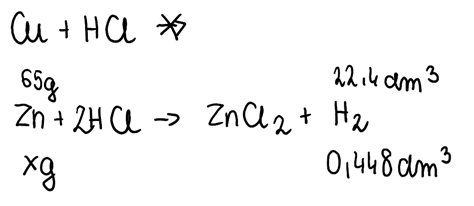
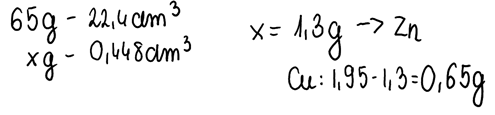
2. Znając masy pierwiastków zawartych w stopie oraz ich masy molowe z układu okresowego, obliczamy liczbę moli pierwiastków zawartych w tym stopie:
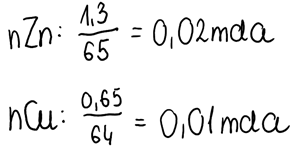
3. Obliczamy stosunek molowy pierwiastków w stopie: