Spośród substancji: Cu, CuO, Na2SO4, K2S wybierz te reagujące z roztworem HCl. Zapisz równania zachodzących reakcji w formie cząsteczkowej i jonowej skróconej.
1) CuO
Równanie reakcji w formie cząsteczkowej:
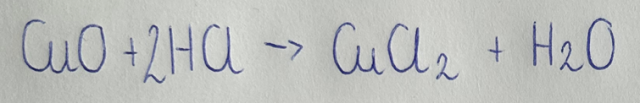
Równanie reakcji w formie jonowej:

Równanie reakcji w formie jonowej skróconej:
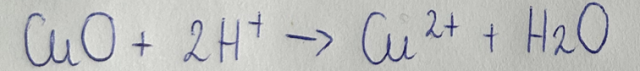
2) K2S
Równanie reakcji w formie cząsteczkowej:

Równanie reakcji w formie jonowej:
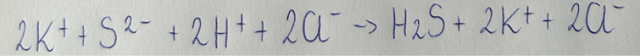
Równanie reakcji w formie jonowej skróconej:


Miedź nie reaguje z kwasem solnym, ponieważ jej potencjał elektrochemiczny, wyższy od potencjału wodoru decyduje o tym, że nie jest ona w stanie wyprzeć wodoru z roztworów kwasów beztlenowych.
Żaden pierwiastek o potencjalne elektrochemicznym dodatnim nie jest w stanie wyprzeć wodoru z roztworów jego kwasów BEZTLENOWYCH. Dla kwasów tlenowych obowiązują osobne warunki.
Na2SO4 nie reaguje z kwasem solnym, ponieważ w wyniku tej reakcji wszystkie produkty uległyby w roztworze wodnym rozpadowi na jony. Aby zaszła reakcja chemiczna niezbędne jest np. wytrącenie się w jej wyniku osadu, wydzielenie gazu (jak w przypadku siarczku potasu), roztworzenie osadu (jak w przypadku tlenku miedzi (II)), zobojętnienie.

Ćwiczenie 1.
206Ćwiczenie 2.
206Ćwiczenie 4.
206Ćwiczenie 6.
207Ćwiczenie 7.
207Ćwiczenie 5.
213Ćwiczenie 2.
218Ćwiczenie 3.
218Ćwiczenie 2.
225Ćwiczenie 3.
225Ćwiczenie 5.
225Ćwiczenie 6.
226Ćwiczenie 1.
236Ćwiczenie 2.
236Ćwiczenie 5.
236Ćwiczenie 1.
242Ćwiczenie 2.
243Ćwiczenie 6.
243Ćwiczenie 7.
243Ćwiczenie 3.
250Ćwiczenie 5.
250Ćwiczenie 2.
254Ćwiczenie 5.
254Ćwiczenie 1.
262Ćwiczenie 2.
262Ćwiczenie 5.
262Ćwiczenie 7.
262Ćwiczenie 1.
268Ćwiczenie 2.
268Ćwiczenie 3.
268Ćwiczenie 4.
268Ćwiczenie 1.
270Ćwiczenie 2.
271Ćwiczenie 3.
271Ćwiczenie 5.
271Ćwiczenie 7.
272Ćwiczenie 8.
272Ćwiczenie 9.
272Ćwiczenie 18.
273Ćwiczenie 19.
274
