Zapisz równanie reakcji dysocjacji podanego związku, a następnie nazwij aniony występujące w ich wodnych roztworach.
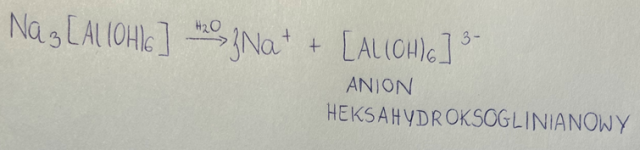

Podany związek kompleksowy powstaje w wyniku syntezy z tlenku bądź wodorotlenku amfoterycznego (Al2O3 lub Al(OH)3) oraz zasady (NaOH). Ma on budowę jonową, dlatego w roztworze wodnym dysocjuje na kation metalu i złożony anion. Nazewnictwo takich anionów tworzy się w sposób następujący:
1. W zależności od ilości grup wodorotlenowych, nazwę zaczynamy od słowa „anion”, a następnie dla liczby koordynacyjnej 4 wprowadzamy początek „tetrahydrokso-„, zaś dla 6- „heksahydrokso”.
2. W zależności od tego, jaki metal występuje w anionie, do jego nazwy dodajemy końcówkę „-anowy”, np. glin- glinianowy, cynk- cynkanowy, miedź- miedzianowy itd.
Aby ustalić ładunek anionu, należy do ilości ładunków ujemnych wprowadzonych przez grupy -OH (jedna grupa ma ładunek -I, a występuje ich w tych związkach 4 bądź 6) dodać ładunek metalu- zwykle jest to +II bądź +III.

Ćwiczenie 1.
206Ćwiczenie 2.
206Ćwiczenie 4.
206Ćwiczenie 6.
207Ćwiczenie 7.
207Ćwiczenie 5.
213Ćwiczenie 2.
218Ćwiczenie 3.
218Ćwiczenie 2.
225Ćwiczenie 3.
225Ćwiczenie 5.
225Ćwiczenie 6.
226Ćwiczenie 1.
236Ćwiczenie 2.
236Ćwiczenie 5.
236Ćwiczenie 1.
242Ćwiczenie 2.
243Ćwiczenie 6.
243Ćwiczenie 7.
243Ćwiczenie 3.
250Ćwiczenie 5.
250Ćwiczenie 2.
254Ćwiczenie 5.
254Ćwiczenie 1.
262Ćwiczenie 2.
262Ćwiczenie 5.
262Ćwiczenie 7.
262Ćwiczenie 1.
268Ćwiczenie 2.
268Ćwiczenie 3.
268Ćwiczenie 4.
268Ćwiczenie 1.
270Ćwiczenie 2.
271Ćwiczenie 3.
271Ćwiczenie 5.
271Ćwiczenie 7.
272Ćwiczenie 8.
272Ćwiczenie 9.
272Ćwiczenie 18.
273Ćwiczenie 19.
274
