Zapisz w formie cząsteczkowej równania reakcji udawadniajace amfoteryczny charakter tlenku chromu (III), mając na uwadze, że produktem jednej z reakcji jest heksahydroksochromian (III) sodu.
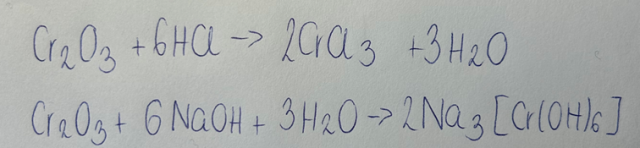

Tlenki, które tworzą sole w reakcji z kwasami i zasadami, nazywamy tlenkami amfoterycznymi.
Nazewnictwo związku powstałego w reakcji drugiej (związku kompleksowego) tworzy się w następujący sposób:
1. W zależności od ilości grup wodorotlenowych, nazwę zaczynamy od słowa „anion”, a następnie dla liczby koordynacyjnej 4 wprowadzamy początek „tetrahydrokso-„, zaś dla 6- „heksahydrokso”.
2. W zależności od tego, jaki metal występuje w anionie, do jego nazwy dodajemy końcówkę „-an” bądź „-ian”, np. glin- glinian, cynk- cynkan, miedź- miedzian, chrom- chromian itd.
3. Na koniec dodajemy nazwę kationu w dopełniaczu- w opisanym przypadku- „sodu”.
Aby ustalić ładunek anionu w związku kompleksowym, należy do ilości ładunków ujemnych wprowadzonych przez grupy -OH (jedna grupa ma ładunek -I, a występuje ich w tych związkach 4 bądź 6) dodać ładunek metalu- zwykle jest to +II bądź +III.

Ćwiczenie 1.
206Ćwiczenie 2.
206Ćwiczenie 4.
206Ćwiczenie 6.
207Ćwiczenie 7.
207Ćwiczenie 5.
213Ćwiczenie 2.
218Ćwiczenie 3.
218Ćwiczenie 2.
225Ćwiczenie 3.
225Ćwiczenie 5.
225Ćwiczenie 6.
226Ćwiczenie 1.
236Ćwiczenie 2.
236Ćwiczenie 5.
236Ćwiczenie 1.
242Ćwiczenie 2.
243Ćwiczenie 6.
243Ćwiczenie 7.
243Ćwiczenie 3.
250Ćwiczenie 5.
250Ćwiczenie 2.
254Ćwiczenie 5.
254Ćwiczenie 1.
262Ćwiczenie 2.
262Ćwiczenie 5.
262Ćwiczenie 7.
262Ćwiczenie 1.
268Ćwiczenie 2.
268Ćwiczenie 3.
268Ćwiczenie 4.
268Ćwiczenie 1.
270Ćwiczenie 2.
271Ćwiczenie 3.
271Ćwiczenie 5.
271Ćwiczenie 7.
272Ćwiczenie 8.
272Ćwiczenie 9.
272Ćwiczenie 18.
273Ćwiczenie 19.
274
