Pierwiastek o konfiguracji elektronowej [2, 8, 5] to fosfor.

Między atomami wodoru i fluoru utworzy się wiązanie atomowe (kowalencyjne).

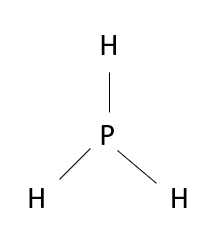
Konfiguracja elektronowa [2, 8, 5] oznacza, że atom pierwiastka posiada 3 powłoki elektronowe i 5 elektronów walencyjnych. Liczba powłok elektronowych jest określona przez numer okresu, natomiast liczba elektronów walencyjnych jest określona przez cyfrę jedności w numerze grupy, co oznacza, że pierwiastek znajduje się w 15. grupie i 3. okresie. Z układu okresowego pierwiastków chemicznych możesz odczytać, że w tej grupie i okresie znajduje się fosfor. Ponadto, sumując elektrony na wszystkich powłokach elektronowych, otrzymać możesz liczbę atomową, dzięki której również można zlokalizować pierwiastek w układzie okresowym. Elektroujemności pierwiastków możesz odczytać z tablic elektroujemności. Elektroujemność wodoru wynosi 2,1, a elektroujemność fosforu również wynosi 2,1. Różnica elektroujemności atomów tworzących wiązanie między fosforem a wodorem wynosi 2,1 – 2,1 = 0. Umownie przyjęto, że jeżeli różnica elektroujemności ma wartość mniejszą lub równą 0,4, to wiązanie ma charakter atomowy (kowalencyjny). Atom fosforu posiada 5 elektronów walencyjnych, a więc do osiągnięcia oktetu elektronowego brakuje mu 3 elektronów. Atom wodoru posiada 1 elektron walencyjny. W celu uzyskania oktetu elektronowego atom fosforu musi utworzyć wiązania z 3 atomami wodoru.