1. pH roztworu węglanu sodu.
![]()
![]() , więc
, więc
![]()
![]() ,
,
![]()
![]()
gdzie:
![]() - całkowite stężenie zasady
- całkowite stężenie zasady
dla
![]() więc
więc
![]() i wtedy
i wtedy
![]()
![]()
![]()
Oznaczamy
![]() i otrzymujemy wzór:
i otrzymujemy wzór:
![]()
Podstawiamy wartości liczbowe:
![]()
![]()
Czyli
![]()
![]()
2. pH roztworu amfiprotem
![]()
W roztworze występują równowagi:
![]()
![]()
![]()
![]()
![]()
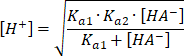
![]() oraz
oraz
![]() .
.
Dla roztworu wodorowęglanu:
![]()
![]() , więc
, więc
![]()
Odpowiedź: Roztwór
![]() o stężeniu 1 mol/dm3 ma pH = 12,15, a roztwór
o stężeniu 1 mol/dm3 ma pH = 12,15, a roztwór
![]() o takim samym stężeniu – pH = 8,3.
o takim samym stężeniu – pH = 8,3.

1. pH roztworu węglanu sodu.
Jon
![]() jest zasadą Brønsteda, więc w roztworze wodnym ulega dysocjacji zasadowej zgodnie z równaniem:
jest zasadą Brønsteda, więc w roztworze wodnym ulega dysocjacji zasadowej zgodnie z równaniem:
![]()
![]() , więc
, więc
![]()
![]() ,
,
![]()
W tej reakcji powstaje jon wodorowęglanowy (
![]() ), który jest znacznie słabszą zasadą niż jon
), który jest znacznie słabszą zasadą niż jon
![]() (porównanie wartości:
(porównanie wartości:
![]() ), więc jego dysocjację zasadową można pominąć.
), więc jego dysocjację zasadową można pominąć.
![]()
gdzie:
![]() - całkowite stężenie zasady
- całkowite stężenie zasady
dla
![]() więc
więc
![]() i wtedy
i wtedy
![]()
Na przykład, gdy
![]() , czyli możemy skorzystać z uproszczonego wzoru, więc
, czyli możemy skorzystać z uproszczonego wzoru, więc
![]()
![]()
Jeżeli stężenie zasady jest małe, np.
![]() , wtedy
, wtedy
![]() i trzeba korzystać z pełnego wzoru na
i trzeba korzystać z pełnego wzoru na
![]() .
.
Oznaczamy
![]() i otrzymujemy wzór:
i otrzymujemy wzór:
![]()
Podstawiamy wartości liczbowe:
![]()
![]()
![]()
![]()
Czyli
![]()
![]()
3. pH roztworu amfiprotem
![]()
Jon
![]() jest amfiprotem, więc może zarówno przyjąć jon wodoru, jak i go oddać. Do tej pory nie obliczaliśmy pH takich roztworów, więc tu wyprowadzimy odpowiednią zależność na ogólnych wzorach
jest amfiprotem, więc może zarówno przyjąć jon wodoru, jak i go oddać. Do tej pory nie obliczaliśmy pH takich roztworów, więc tu wyprowadzimy odpowiednią zależność na ogólnych wzorach
![]() .
.
W roztworze występują równowagi:
![]()
![]()
Pomijamy autodysocjację wody. W roztworze zawierającym jony amfiprotu
![]() jony
jony
![]() pojawiają się w wyniku dysocjacji kwasowej amfiprotu (
pojawiają się w wyniku dysocjacji kwasowej amfiprotu (
![]() ), a zużywane w wyniku dysocjacji zasadowej amfiprotu (
), a zużywane w wyniku dysocjacji zasadowej amfiprotu (
![]() ).
).
Dlatego:
![]()
Podstawiamy stężenia
![]() ze wzorów na stałe dysocjacji
ze wzorów na stałe dysocjacji
![]() .
.
![]()
Mnożymy obie strony przez
![]() wyrazy z
wyrazy z
![]() przenosimy na lewą stronę równania i wyłączamy
przenosimy na lewą stronę równania i wyłączamy
![]() przed nawias:
przed nawias:
![]()
Dzielimy obie strony równania przez wyrażenie w nawiasie i wyciągamy pierwiastek, żeby otrzymać stężenie jonów
![]() .
.
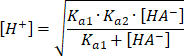
Gdy stężenie amfiprotu jest dużo większe niż wartość
![]() , w mianowniku pod pierwiastkiem można pominąć
, w mianowniku pod pierwiastkiem można pominąć
![]() i wtedy skraca się wyraz
i wtedy skraca się wyraz
![]() .
.
Ostatecznie otrzymujemy:
![]() oraz
oraz
![]() .
.
Dla roztworu wodorowęglanu:
![]()
![]() , więc
, więc
![]()
Odpowiedź: Roztwór
![]() o stężeniu 1 mol/dm3 ma pH = 12,15, a roztwór
o stężeniu 1 mol/dm3 ma pH = 12,15, a roztwór
![]() o takim samym stężeniu – pH = 8,3.
o takim samym stężeniu – pH = 8,3.