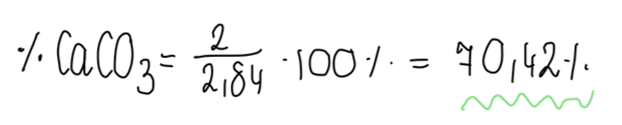

Należy przeliczyć objętość wydzielonego gazu z cm3 na dm3 (pamiętając, że 1cm3 to 0,001 dm3). Będzie to niezbędne do dalszych obliczeń, mając na uwadze fakt, że 1 mol gazu w warunkach normalnych zajmuje objętość 22,4 dm3:
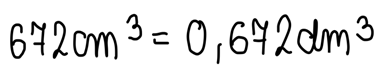
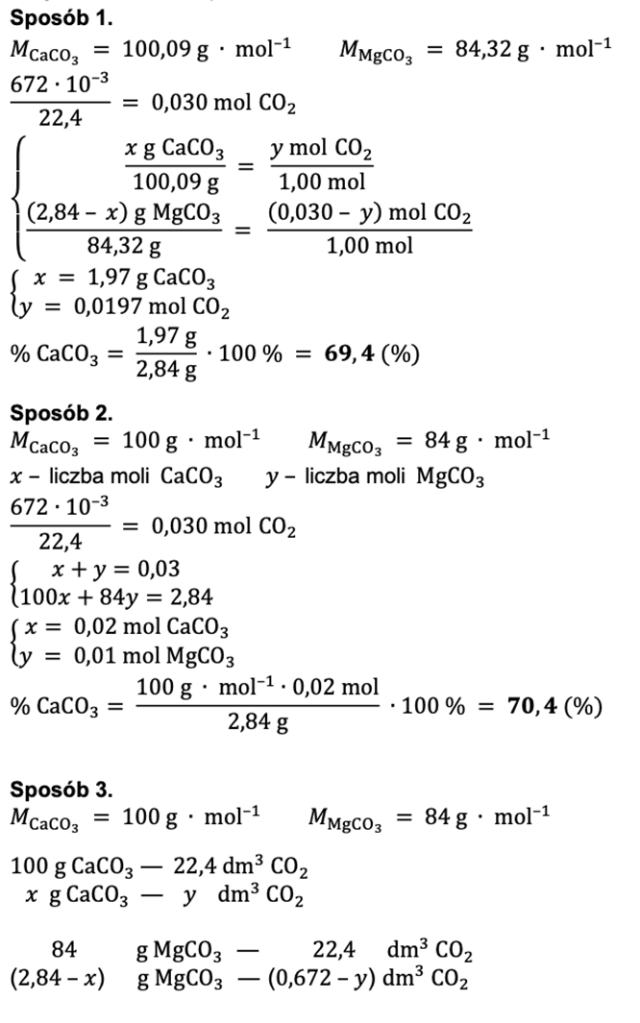
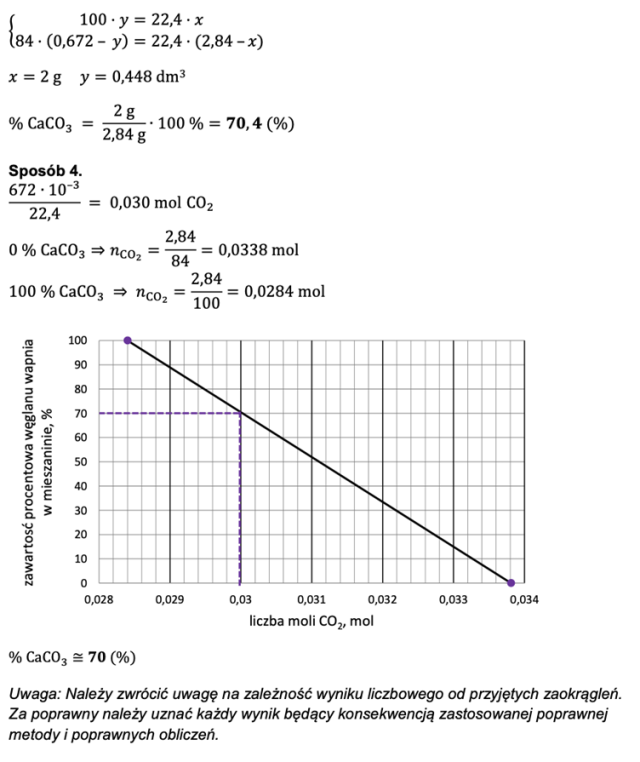
Zapisujemy równania zachodzących reakcji (obie sole reagują z HCl) i wprowadzamy dane zawarte w treści zadania. Masę pierwszej soli oznaczamy jako niewiadomą x, a masa drugiej soli to pozostałość z całej masy badanej próbki. Objętość wydzielonego dwutlenku węgla z pierwszej reakcji oznaczamy jako niewiadomą y, zaś objętość wydzielonego CO2 w drugiej reakcji to pozostałość z całości wydzielonego w obu reakcjach gazu.
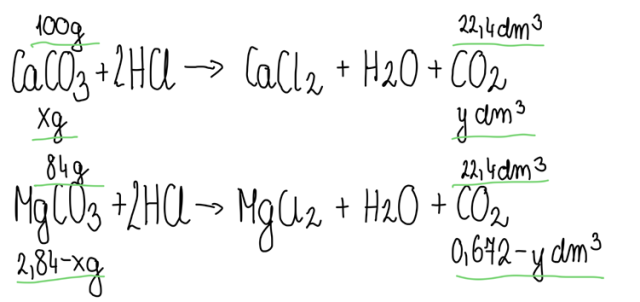
Na bazie przedstawionych danych sporządzamy proporcję, z których wynika układ równań, na bazie którego obliczamy masy poszczególnych składników w mieszaninie.
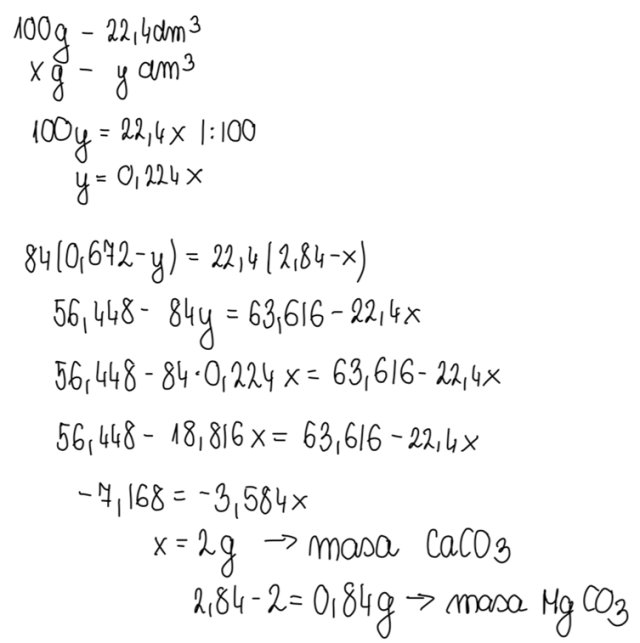
Obliczamy zawartość procentową węglanu wapnia w mieszaninie o masie 2,84g.