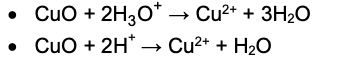

Równanie zachodzącej reakcji w formie cząsteczkowej:
CuO + H2SO4 -> CuSO4 + H2O
Aby porównać aktywność pierwiastków, należy skorzystać z szeregu elektrochemicznego metali.
Im niższy potencjał standardowy, tym większa aktywność pierwiastka. Mniej aktywny pierwiastek nie wyprze bardziej aktywnego z roztworu jego kwasu czy soli.
W doświadczeniu użyto tlenku miedzi (II), ponieważ ma on pożądaną budowę- MeO, sugerującą, że metal musi być dwuwartościowy. Srebro, które również spełniałoby warunek, jakim jest niereagowanie z HCl, nie tworzy tlenku o takim wzorze.
Miedź nie reaguje z kwasem solnym, ponieważ ma potencjał standardowy wyższy od wodoru, a co za tym idzie- nie jest w stanie wyprzeć wodoru z roztworu jego kwasu.
Co więcej, roztwory miedzi, w których znajdują się jonu Cu2+ zawsze mają niebieską barwę.