1.Zapisujemy równanie reakcji hydrolizy soli, czyli jej rozpadu pod wpływem wody w formie cząsteczkowej, a następnie jonowej skróconej:
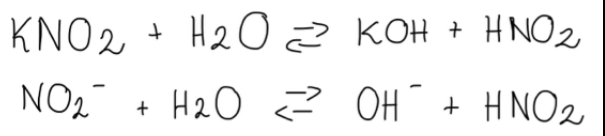
(HNO2 jest elektrolitem słabym, zatem nie rozpisujemy go na jony).
Jest to hydroliza zasadowa, ponieważ ową sól tworzą mocna zasada i słaby kwas, a dowodem na to są powstające w produktach jony OH-.
2. Zapisujemy wyrażenie na stałą równowagi opisanej reakcji, która jest ilorazem iloczynu stężeń produktów i iloczynu stężeń substratów, z pominięciem wody:
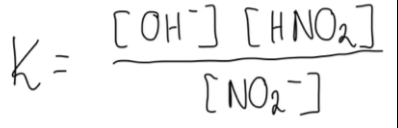
(kwadratowe nawiasy oznaczają zawsze stężenie molowe substacji)
3. Znając pH, obliczamy stężenie anionów wodorotlenkowych w roztworze:
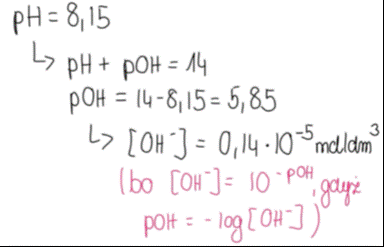
Roztwór ma odczyn zasadowy, więc interesuje nas pOH, gdyż w produktach powstają jony OH-.
4. Konstruujemy tabelę, która pozwoli ustalić stężenia równowagowe reagentów:
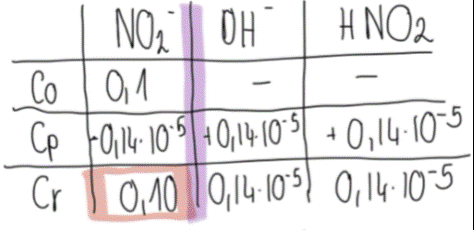
· C0 to stężęnie początkowe. Stężenie początkowe soli zostało podane w treści zadania, zaś na samym początku przeprowadzania reakcji, w mieszaninie nie ma produktów.
· Cp to stężenie, które uległo reakcji- substratu ubywa, produktów przybywa. Skoro wiemy, jakie było stężenie jonów OH- po reakcji, tyle samo musiało ich przybyć w jej trakcie, gdyż na początku nie mieliśmy w układzie produktu.
· Cr to stężenie równowagowe- ilości reagentów w stanie równowagi.
Konstruując tabelę i wykonując obliczenia zwracamy uwagę na stosunek stechiometryczny reagentów- wszystkich jest po jednym molu, więc jest to stosunek 1:1:1.
5. Korzystamy z obliczonych stężeń równowagowych, podstawiając je do wzoru na stałą równowagi hydrolizy zasadowej:
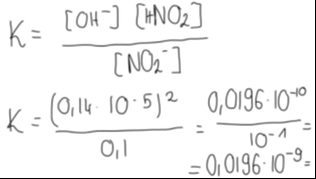

UWAGA: pamiętajmy o przybliżeniu zdefiniowanym w treści zadania- wynik ma być podany z dokładnością do drugiego miejsca po przecinku.
