Azot:
Konfiguracja powłokowa: K2L5
Każdy z pierwiastków chce osiągnąć oktet elektronowy, czyli 8 elektronów na ostatniej powłoce. Atom azotu musi przyjąć 3 elektrony, aby osiągnąć pełną konfiguracje elektronową. Przyjmując 3 elektrony staje się anionem N3-.
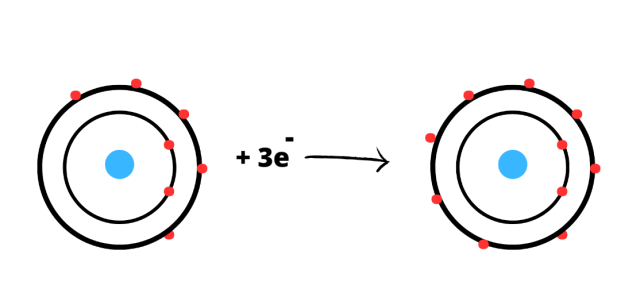
Schemat powstawania jonów z atomów:
Siarka:
Konfiguracja powłokowa: K2L8M6
Każdy z pierwiastków chce osiągnąć oktet elektronowy, czyli 8 elektronów na ostatniej powłoce. Atom siarki musi przyjąć 2 elektrony, aby osiągnąć pełną konfiguracje elektronową. Przyjmując 2 elektrony staje się anionem S2-.
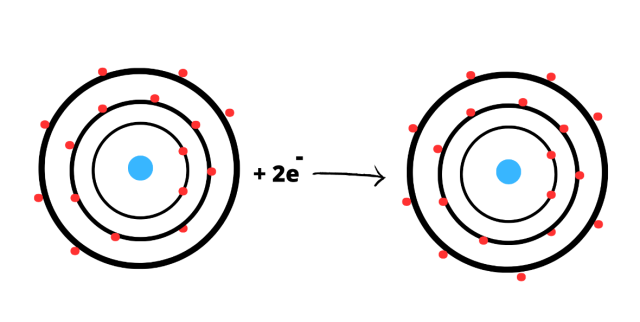
Schemat powstawania jonów z atomów:
Beryl:
Konfiguracja powłokowa: K2L2
Każdy z pierwiastków chce osiągnąć oktet elektronowy, czyli 8 elektronów na ostatniej powłoce. Atom berylu natomiast chce osiągnąć konfiguracje helu, czyli dublet elektronowy (2 elektrony na ostatniej powłoce). Atom berylu musi oddać 2 elektrony, aby osiągnąć pełną konfiguracje elektronową. Oddając 2 elektrony staje się kationem Be2+.
Schemat powstawania jonów z atomów:
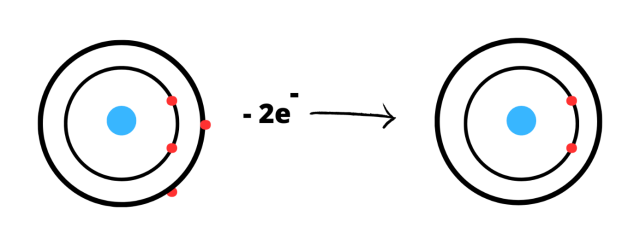
Magnez:
Konfiguracja powłokowa: K2L8M2
Każdy z pierwiastków chce osiągnąć oktet elektronowy, czyli 8 elektronów na ostatniej powłoce. Atom magnezu musi oddać 2 elektrony, aby osiągnąć pełną konfiguracje elektronową. Oddając 2 elektrony staje się kationem Mg2+.
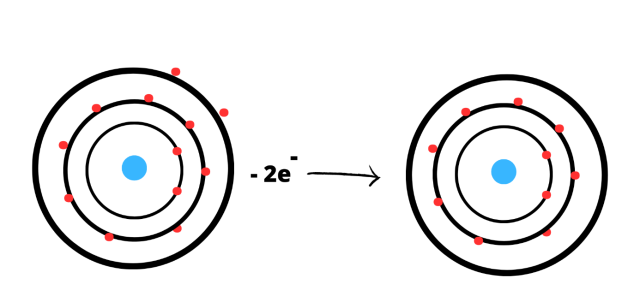
Schemat powstawania jonów z atomów:

Oznaczenia powłok elektronowych: K, L, M, N, O, P, Q.
Aby rozpisać zapis konfiguracji elektronowej musimy określić liczbę powłok danego atomu. Numer okresu określa liczbę powłok, np. azot. Azot leży w 2 okresie, oznacza to, że elektrony rozpisujemy na 2 powłokach. Azot ma 7 elektronów. Leży w 15stej grupie, czyli ma 5 elektronów walencyjnych.
Powłoka K jest pierwsza powłoką, więc we wzorze 2n2 za n podstawiamy 1. Dla powłoki K – powłoki 1: 2n2 = 2 ∙ 12 = 2.
Konfiguracja elektronowa fluoru: K2L5