Oblicz stężenie molowe H+ w 0,1-molowym kwasie octowym.
0,0013 mol/dm3, nie

Dysocjacja kwasu octowego:
![]()
Z 1 mola kwasu powstaje 1 mol H+.
Stopień dysocjacji to stosunek stężenia cząsteczek zdysocjowanych do stężenia początkowego.
![]()
Wzór na stężenie H+:
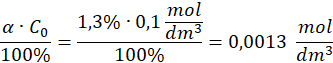
![]()

Ćwiczenie 17.2.
307Ćwiczenie 17.3.
307Ćwiczenie 17.7.
308Ćwiczenie 17.9.
309Ćwiczenie 17.10.
309Ćwiczenie 17.12.
310Ćwiczenie 17.13.
310Ćwiczenie 17.17.
310Ćwiczenie 17.19.
311Ćwiczenie 17.20.
311Ćwiczenie 17.22.
311Ćwiczenie 17.23.
311Ćwiczenie 17.25.
312Ćwiczenie 17.46.
314Ćwiczenie 17.47.
314Ćwiczenie 17.48.
314Ćwiczenie 17.49.
315Ćwiczenie 17.50.
315Ćwiczenie 17.51.
315Ćwiczenie 17.52.
315Ćwiczenie 17.53.
315Ćwiczenie 17.55.
316Ćwiczenie 17.56.
316Ćwiczenie *17.62.
317Ćwiczenie *17.63.
317Ćwiczenie 17.77.
319Ćwiczenie 17.78.
319Ćwiczenie 17.79.
319Ćwiczenie 17.80.
319Ćwiczenie 17.81.
319Ćwiczenie 17.82.
319Ćwiczenie 17.83.
320Ćwiczenie 17.84.
320Ćwiczenie 17.86.
320Ćwiczenie 17.88.
320Ćwiczenie 17.89.
320Ćwiczenie 17.90.
321Ćwiczenie 17.93.
321Ćwiczenie 17.95.
321Ćwiczenie 17.96.
321Ćwiczenie 17.97.
321Ćwiczenie 17.98.
322Ćwiczenie 17.99.
322Ćwiczenie **17.101.
322Ćwiczenie 17.102.
322Ćwiczenie 17.118.
324Ćwiczenie 17.120.
324Ćwiczenie 17.125.
325Ćwiczenie 17.126.
325Ćwiczenie 17.127.
325Ćwiczenie 17.133.
326Ćwiczenie 17.134.
326Ćwiczenie 17.136.
327Ćwiczenie 17.154.
329Ćwiczenie 17.155.
329Ćwiczenie 17.157.
329Ćwiczenie 17.162.
330Ćwiczenie *17.171.
330Ćwiczenie 17.172.
331
