Oblicz ilość wydzielonego wodoru.
0,574 dm3.

Zachodzi reakcja:
![]()
Z równania wynika, że z 2 molami fenolu – 188 g reagują 2 mole potasu – 78 g. Obliczmy, który substrat został użyty w nadmiarze.
188 g – 78 g K
x g – 2 g K
![]()
Fenol został użyty w nadmiarze, ilość powstałego wodoru liczymy z ilości użytego potasu:
78 g K – 22,4 dm3 H2
2 g K – y dm3
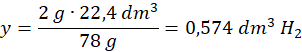

Ćwiczenie 17.2.
307Ćwiczenie 17.3.
307Ćwiczenie 17.7.
308Ćwiczenie 17.9.
309Ćwiczenie 17.10.
309Ćwiczenie 17.12.
310Ćwiczenie 17.13.
310Ćwiczenie 17.17.
310Ćwiczenie 17.19.
311Ćwiczenie 17.20.
311Ćwiczenie 17.22.
311Ćwiczenie 17.23.
311Ćwiczenie 17.25.
312Ćwiczenie 17.46.
314Ćwiczenie 17.47.
314Ćwiczenie 17.48.
314Ćwiczenie 17.49.
315Ćwiczenie 17.50.
315Ćwiczenie 17.51.
315Ćwiczenie 17.52.
315Ćwiczenie 17.53.
315Ćwiczenie 17.55.
316Ćwiczenie 17.56.
316Ćwiczenie *17.62.
317Ćwiczenie *17.63.
317Ćwiczenie 17.77.
319Ćwiczenie 17.78.
319Ćwiczenie 17.79.
319Ćwiczenie 17.80.
319Ćwiczenie 17.81.
319Ćwiczenie 17.82.
319Ćwiczenie 17.83.
320Ćwiczenie 17.84.
320Ćwiczenie 17.86.
320Ćwiczenie 17.88.
320Ćwiczenie 17.89.
320Ćwiczenie 17.90.
321Ćwiczenie 17.93.
321Ćwiczenie 17.95.
321Ćwiczenie 17.96.
321Ćwiczenie 17.97.
321Ćwiczenie 17.98.
322Ćwiczenie 17.99.
322Ćwiczenie **17.101.
322Ćwiczenie 17.102.
322Ćwiczenie 17.118.
324Ćwiczenie 17.120.
324Ćwiczenie 17.125.
325Ćwiczenie 17.126.
325Ćwiczenie 17.127.
325Ćwiczenie 17.133.
326Ćwiczenie 17.134.
326Ćwiczenie 17.136.
327Ćwiczenie 17.154.
329Ćwiczenie 17.155.
329Ćwiczenie 17.157.
329Ćwiczenie 17.162.
330Ćwiczenie *17.171.
330Ćwiczenie 17.172.
331
