Oblicz ilość azotu, która zawiera tyle atomów co p gramów etylenu.
W 3p [g]

W 1 molu substancji jest 6,02 ∙ 1023 drobin.
m C2H4 = 28 g/mol
Ilość atomów w p g etylenu (mnożymy ilość cząsteczek w 1 molu razy 6 – cząsteczka etylenu zawiera 6 atomów):
6 ∙ 6,02 ∙ 1023– 28 g
x – p g
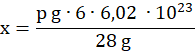
![]()
Używając masy molowej azotu obliczamy masę próbki azotu zawierającej 1,29p ∙ 1023 atomów (mnożymy ilość cząsteczek w 1 molu razy 2 – cząsteczki azotu są dwuatomowe):
m N2 = 28 g/mol
2 ∙ 6,02 ∙ 1023– 28 g
1,29 p ∙ 1023– x g
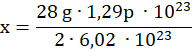
![]()

Ćwiczenie 2.2.
40Ćwiczenie 2.3.
40Ćwiczenie 2.6.
40Ćwiczenie 2.14.
41Ćwiczenie 2.15.
41Ćwiczenie 2.16.
41Ćwiczenie **2.18.
41Ćwiczenie 2.20.
42Ćwiczenie 2.32.
43Ćwiczenie *2.33.
43Ćwiczenie *2.35.
43Ćwiczenie 2.39.
46Ćwiczenie 2.40.
46Ćwiczenie 2.41.
46Ćwiczenie 2.42.
46Ćwiczenie 2.43.
46Ćwiczenie 2.44.
46Ćwiczenie 2.45.
46Ćwiczenie 2.46.
46Ćwiczenie 2.47.
47Ćwiczenie 2.48.
47Ćwiczenie 2.49.
47Ćwiczenie 2.52.
47Ćwiczenie 2.55.
47Ćwiczenie 2.56.
47Ćwiczenie **2.57.
47Ćwiczenie 2.58.
47Ćwiczenie 2.60.
48Ćwiczenie 2.61.
48Ćwiczenie 2.65.
48Ćwiczenie 2.86.
50Ćwiczenie 2.87.
50Ćwiczenie 2.90.
50Ćwiczenie 2.92.
50Ćwiczenie 2.96.
51Ćwiczenie *2.101.
51Ćwiczenie 2.102.
51Ćwiczenie 2.115.
52Ćwiczenie *2.122.
52Ćwiczenie **2.123.
52Ćwiczenie 2.128.
54
