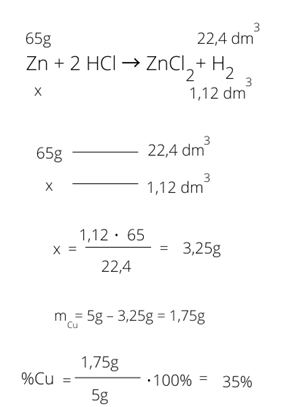
Odpowiedź: Procentowa zawartość miedzi w stopie wynosi 35%.

Miedź jest metalem mniej aktywnym od wodoru, więc nie wyprze go z kwasu.
HCl + Cu → reakcja nie zachodzi
2HCl + Zn → ZnCl2 + H2
Nad równaniem zapisujemy sobie dane, które odczytamy z układu okresowego. Odczytujemy masę molową cynku, która wynosi 65 g/mol i zapisujemy ją nad cynkiem. Pod cynkiem zapisujemy x, ponieważ w zadaniu mamy obliczyć zawartość % miedzi. Skoro stop o masie 5 g składa się z miedzi oraz cynku, to obliczając masę cynku i odejmując ją od 5 g, otrzymamy masę miedzi. W zadaniu mamy podane, że wydzieliło się 1,12 dm3. Wiemy, że jeden mol zajmuje w warunkach normalnych 22,4 dm3, dlatego nad wodorem zapisujemy 22,4 dm3, a pod wodorem dane z zadania, czyli 1,12 dm3. Liczymy x z proporcji.
Następnie od masy stopu odejmujemy masę cynku i otrzymujemy masę miedzi. Mamy obliczyć zawartość procentową miedzi w stopie, więc dzielimy masę miedzi przez masę całego stopu.