a) Wartość elektroujemności dla wodoru EH = 2,1
b) Wartość elektroujemności dla bromu EBr = 2,8
c) Różnica wartości elektroujemności ∆E = 2,8 -2,1 = 0,7
d) Spodziewane wiązanie chemiczne: Wiązanie kowalencyjne spolaryzowane
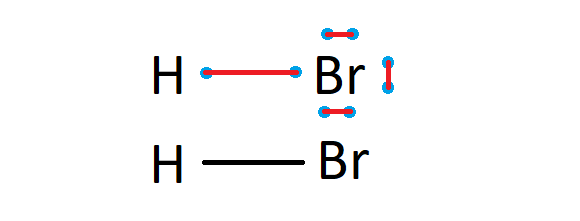

Elektroujemność – miara siły przyciągania elektronów w atomie, tworzących wiązania w cząsteczce przez atomy danego pierwiastka chemicznego.
Rodzaje wiązań w zależności od zakresu elektroujemności:
Wiązanie kowalencyjne niespolaryzowane – 0≤∆E≤0,4
Wiązanie kowalencyjne spolaryzowane – 0,4<∆E<1,7
Wiązanie jonowe – ∆E≥1,7
Wartości te pozwalają określić jakie wiązanie występuje między pierwiastkami.