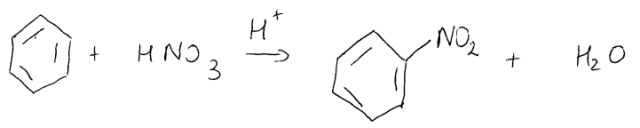
C6H6 – 78 ![]()
C6H5NO2 – 123 ![]()
78 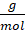
![]()
X → 12,3 g
X = 7,8 g
![]()

Obliczamy najpierw masy molowe benzenu i nitrobenzenu. Następnie z proporcji wyliczamy, ile gramów benzenu potrzeba do otrzymania 12,3 g nitrobenzenu. Otrzymaną wartość dzielimy przez ilość benzenu użytego do reakcji (10 g) i, mnożąc razy 100%, otrzymujemy wynik.