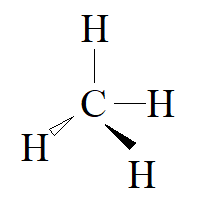
1. W tych cząsteczkach atom centralny wykazuje hybrydyzację typu sp3.
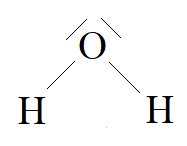
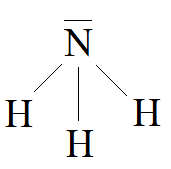
2. Liczba wolnych par elektronowych na atomie centralnym wynosi odpowiednio: w wodzie 2, w amoniaku 1, w metanie 0. W związku z tym cząsteczkawody ma kształt kątowy amoniaku ma kształt piramidy trygonalnej, metanu ma kształt tetraedryczny.
3. Najmniejszy kąt między wiązaniami występuje w cząsteczce wody, ze względu na silne odpychanie między wolnymi parami elektronowymi.
Kąt między wiązaniami charakterystyczny dla tetraedru występuje w cząsteczce metanu, w której występuje jedynie odpychanie między wiążącymi parami elektronowymi.

Wzory kreskowe wody, amoniaku i metanu:
H2O:
NH3:
CH4: