HCl – 36,5 g/mol
NH3 – 17 g/mol
1 mol – 22,4 dm3
dNH3 =
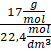 = 0,759 g/dm3
= 0,759 g/dm3
dHCl =
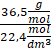 = 1,629 g/dm3
= 1,629 g/dm3
gęstość powietrza: 1,29 g/dm3
NH3 – schemat I
HCl — schemat II

Znając masy molowe obu gazów oraz fakt, że mol dowolnego gazów w warunkach normalnych ma 22,4 dm3 możemy policzyć gęstość i porównać ją z tablicową gęstością powietrza. Gaz mający większą gęstość (HCl) może być zbierany do normalnie postawionej kolby płaskodennej, natomiast amoniak musi być zbierany do kolby odwróconej do góry dnem, gdyż jest od powietrza lżejszy.