1. W cząsteczce wody występują wiązania kowalencyjne spolaryzowane. Ze względu na większą elektroujemność tlenu względem wodoru wspólna para elektronowa wiązania tlen-wodór jest przesunięta w kierunku atomu tlenu.
2. Kąt pomiędzy wiązaniami O-H w cząsteczce wody (w fazie ciekłej) wynosi ok. 105°. Cząsteczka o dwóch przeciwnie naładowanych biegunach to cząsteczka dipolowa. Dipolowy charakter cząsteczki wody spowodowany jest jej budową kątową oraz rodzajem wiązania. Cząsteczka wody wykazuje od strony tlenu niewielki ładunek ujemny, a od strony wodorów – niewielki ładunek dodatni. Z wyżej opisanych powodów mówimy, że cząsteczka wody jest polarna.
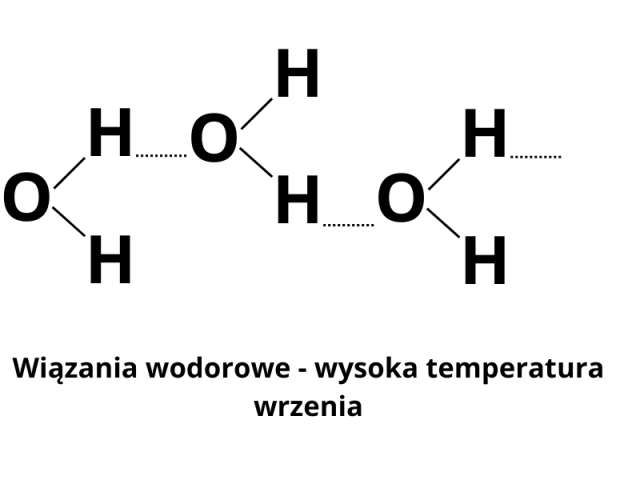
3. Cząsteczki wody (dipole) oddziałują pomiędzy sobą, tworząc tzw. wiązanie wodorowe. Z tego powodu woda ma wysoką temperaturę wrzenia w porównaniu z cząsteczkami mniej polarnymi lub niepolarnymi o nawet większej masie cząsteczkowej. Z budowy cząsteczek wody wynika fakt, że woda jest bardzo dobrym rozpuszczalnikiem substancji polarnych.

Elektroujemność wodoru = 2,1
Elektroujemność tlenu = 3,5
Różnica elektroujemności = 1,4
Wiązanie kowalencyjne spolaryzowane – różnica elektroujemności 0,4 − 1,7 – jest przesunięte w stronę pierwiastka bardziej elektroujemnego.
Cząsteczka wody ma 2 bieguny ujemne w pobliżu atomu tlenu i dodatni w pobliżu atomów wodoru. Cząsteczka wody jest dipolem, czyli innymi słowy, ma budowę polarną, co zapisujesz w następujący sposób:
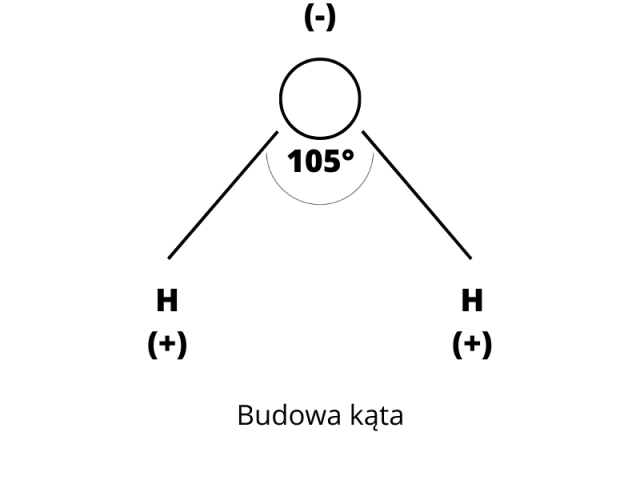
Wiązania cząsteczek wody tworzą kąt około 105 °.
Budowa polarna cząsteczki wody wpływa na zdolność rozpuszczania się w niej substancji. Dobrze rozpuszczają się w wodzie substancje o budowie polarnej, a więc takie, których cząsteczki również mają 2 bieguny. Gdy substancję polarną rozpuszcza się w wodzie, wówczas cząsteczki ustawiają się w taki sposób, aby dodatni biegun cząsteczki wody stykał się z biegunem ujemnym cząsteczki substancji rozpuszczanej i odwrotnie.