Al2(SO4)3 – 342
![]()
Al2(SO4)3∙ 18 H2O – 666
![]()
18 H2O – 324
![]()
500 cm3 H2O → 500 g H2O
27 g Al2(SO4)3→ 100 g H2O
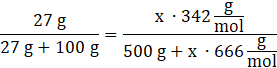
x = 0,5304 mol
666
![]() ∙ 0,5304 mol = 353,25 g
∙ 0,5304 mol = 353,25 g

W przypadku dodawania hydratu do wody masa roztworu jest powiększana o całą masę hydratu, natomiast ilość substancji roztwarzanej jedynie o pewną część masy, którą dodajemy. Przyjmujemy niewiadomą x za liczbę moli substancji wprowadzanej, gdyż będzie ona taka sama dla związku bezwodnego (substancji rozpuszczanej) oraz całego hydratu. Do licznika wstawiamy masę Al2(SO4)3 wymnożoną przez liczbę moli (x), a do mianownika masę hydratu wymnożoną przez x. Całość równa się stałemu stężeniu liczonemu ze wzoru
![]() . Rozwiązujemy równanie dla x i mnożymy ilość moli przez masę molową hydratu, otrzymując ilość gramów hydrat, jaką należy wprowadzić do roztworu.
. Rozwiązujemy równanie dla x i mnożymy ilość moli przez masę molową hydratu, otrzymując ilość gramów hydrat, jaką należy wprowadzić do roztworu.