MgCl2 – 95
![]()
MgCl2∙ 6 H2O – 203
![]()
HCl – 36,5
![]()
Mg + 2 HCl → MgCl2 + H2
400 cm3∙ 1,025
![]() = 410 g
= 410 g
410 g ∙ 5% = 20,5 g
20,5 g ∙ 80% = 16,4 g
95
![]() → 2 ∙ 36,5
→ 2 ∙ 36,5
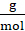
X g → 16,4 g
X = 21,3 g
95
![]() → 203
→ 203
![]()
21,3 g → Y g
Y = 45,5 g
45,5 g ∙ 70% = 31,85 g

Korzystając z informacji o gęstości, objętości i stężeniu procentowym wyliczamy, ile gramów HCl znajduje się w roztworze. Bierzemy 80% tej ilości i podstawiamy do proporcji utworzonej z równania reakcji MgCl2 z HCl. W kolejnej proporcji obliczamy, jaka ilość hydratu odpowiada ilości utworzonego MaCl2. Bierzemy 70% tej wartości i otrzymujemy wynik.