Br2
Sposób łączenia się:
Brom ma siedem elektronów walencyjnych. Do osiągnięcia oktetu elektronowego brakuje mu jednego – zatem dwa atomy bromu uwspólniają sobie po 1 elektronie, tworząc wiązanie pojedyncze.
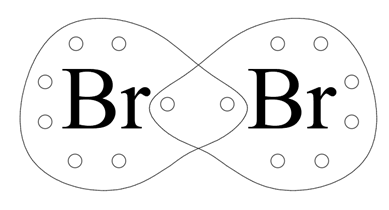
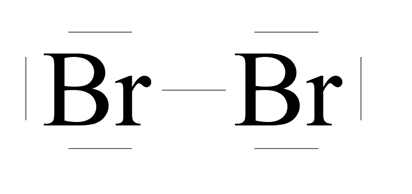
Różnica elektroujemności:
![]()
Rodzaj wiązania: kowalencyjne niespolaryzowane
HI
Sposób łączenia się:
Wodór ma jeden elektron walencyjny. Do osiągnięcia dubletu elektronowego brakuje mu jeszcze jednego. Jod ma siedem elektronów walencyjnych i do oktetu również brakuje mu jednego elektronu. Atomy uwspólniają zatem po jednym elektronie od każdego, tworząc wiązanie pojedyncze.
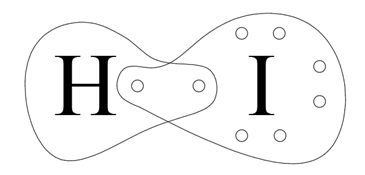
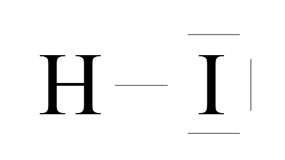
Różnica elektroujemności:
![]()
Rodzaj wiązania: kowalencyjne spolaryzowane
CaCl2
Sposób łączenia się:
Chlor ma siedem elektronów walencyjnych. Do osiągnięcia oktetu elektronowego brakuje mu jednego. Wapń ma dwa elektrony walencyjne, których musi się pozbyć, chcąc osiągnąć konfigurację elektronową najbliższego gazu szlachetnego. Dlatego w cząsteczce chlorku wapnia, wapń oddaje po jednym elektronie dla każdego z chlorów. Wapń staje się kationem wapnia Ca2+, a chlory anionami chlorkowymi Cl-.
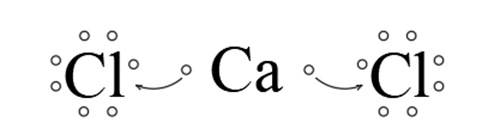
Różnica elektroujemności:
![]()
Rodzaj wiązania: jonowe

Rodzaj wiązania poznasz licząc różnicę elektroujemności. Jeśli różnica elektroujemności mieści się w przedziale 0-0,4 to mamy do czynienia z wiązaniem kowalencyjnym niespolaryzowanym, 0,4-1,7- kowalencyjnym spolaryzowanym, a od 1,7 wzwyż- jonowym.