Wzór związku chemicznego: Al2O3
Glin ma trzy elektrony walencyjne. Tlen ma sześć elektronów walencyjnych. Atom glinu dąży do uzyskania oktetu elektronowego. Uzyska go, gdy odda trzy elektrony. Atomowi tlenu brakuje dwóch elektronów do uzyskania oktetu elektronowego. Zatem każdy z dwóch atomów glinu odda po trzy elektrony w taki sposób, żeby każdy tlen otrzymał dwa elektrony.
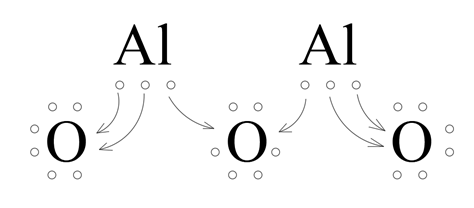
Powstają kationy glinu i aniony tlenowe.
![]()
![]()

Zanim zabierzesz się za rysowanie i równania, ustal, jaka jest różnica elektroujemności między atomami tworzącymi związek chemiczny, a co za tym idzie- z jakim wiązaniem mamy do czynienia. W przypadku tego zadania jest to z góry zdeterminowane, jednak nie zawsze musi być to podane w poleceniu- a przecież inaczej tworzą się wiązania kowalencyjne, a inaczej wiązania jonowe, o czym należy pamiętać.
Napisz wzór związku, który powstał z połączenia tlenu i glinu. Powiedz, ile elektronów walencyjnych ma każdy z nich (dla pierwiastków grup 1. i 2. jest to ilość równa numerowi grupy, dla pierwiastków grup 13-18: N-10, gdzie N odpowiada numerowi grupy). Następnie przypomnij sobie, w jaki sposób tworzą się wiązania jonowe. Są to wiązania pomiędzy metalami a niemetalami. Metale oddają elektrony, przez co powstają kationy. Niemetale przyjmują elektrony, przez co powstają aniony. Wszystkie pierwiastki dążą do uzyskania oktetu elektronowego- konfiguracji stabilnej energetycznej, tożsamej z konfiguracją najbliższego gazu szlachetnego (helowca).