Wodór ma jeden elektron walencyjny. Siarka ma sześć elektronów walencyjnych.
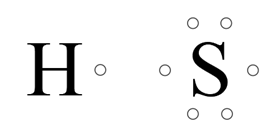
Atom wodoru dąży do uzyskania dubletu elektronowego. Brakuje mu do tego jednego elektronu. Atomowi siarki brakuje dwóch elektronów do uzyskania oktetu elektronowego. Siarka brakujące dwa elektrony uwspólnia z dwoma atomami wodoru. Mamy dwie wspólne pary elektronowe (dwa wiązania pojedyncze) oraz w przypadku siarki, dwie wolne (niewiążące) pary elektronowe.
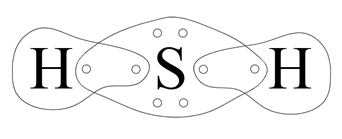
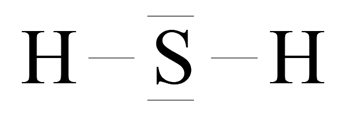
Różnica elektroujemności:
![]() – wiązanie kowalencyjne spolaryzowane
– wiązanie kowalencyjne spolaryzowane

Jeśli różnica elektroujemności (oznaczonej czerwonymi cyframi w układzie okresowym na tyle okładki) jest mniejsza niż 1,7, pierwiastki tworzą równanie kowalencyjne. Jeśli różnica ta mieści się w przedziale 0-0,4, mamy do czynienia z wiązaniem kowalencyjnym niespolaryzowanym, gdy powyżej- kowalencyjnym spolaryzowanym. Jeśli jednak różnica ta wynosiłaby 1,7 i więcej- wiązanie między atomami ma charakter jonowy.
Różnica elektroujemności zawsze jest wartością nieujemną- od wartości większej odejmujemy mniejszą, niezależnie od kolejności występowania pierwiastków we wzorze.