Fluor ma siedem elektronów walencyjnych.

Do uzyskania oktetu elektronowego brakuje mu 1 elektronu. Zatem między atomami fluoru powstaje jedna wspólna para elektronowa- dochodzi do tzw. uwspólnienia elektronów, czyli niejako wzajemnej pożyczki 1 elektronu od siebie wzajemnie. Każdy z atomów uzyskuje wtedy oktet elektronowy: 2 elektrony tworzące jedną wspólną parę elektronową (wiązanie pojedyncze) i 6 elektronów tworzących po 3 wolne pary elektronowe.
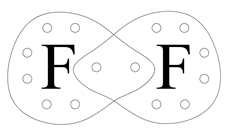
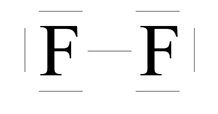
Różnica elektroujemności:
![]() – wiązanie kowalencyjne niespolaryzowane
– wiązanie kowalencyjne niespolaryzowane

Jeśli różnica elektroujemności (oznaczonej czerwonymi cyframi w układzie okresowym na tyle okładki) jest mniejsza niż 1,7, pierwiastki tworzą równanie kowalencyjne. Jeśli różnica ta mieści się w przedziale 0-0,4, mamy do czynienia z wiązaniem kowalencyjnym niespolaryzowanym, gdy powyżej- kowalencyjnym spolaryzowanym. Jeśli jednak różnica ta wynosiłaby 1,7 i więcej- wiązanie między atomami ma charakter jonowy.
Różnica elektroujemności zawsze jest wartością nieujemną- od wartości większej odejmujemy mniejszą, niezależnie od kolejności występowania pierwiastków we wzorze.