Wzór związku chemicznego: CaCl2.
Wapń ma dwa elektrony walencyjne. Chlor ma siedem elektronów walencyjnych. Atom wapnia dąży do uzyskania oktetu elektronowego. Uzyska go, gdy odda dwa elektrony. Atomowi chloru brakuje jednego elektronu do uzyskania oktetu elektronowego. Zatem wapń odda po jednym elektronie dla każdego z dwóch chlorów.
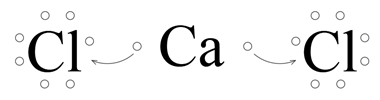
Powstaje kation wapnia i aniony chlorkowe.
![]()
![]()

Zanim zabierzesz się za rysowanie i równania, ustal, jaka jest różnica elektroujemności między atomami tworzącymi związek chemiczny, a co za tym idzie- z jakim wiązaniem mamy do czynienia. W przypadku tego zadania jest to z góry zdeterminowane, jednak nie zawsze musi być to podane w poleceniu- a przecież inaczej tworzą się wiązania kowalencyjne, a inaczej wiązania jonowe, o czym należy pamiętać.
Napisz wzór związku, który powstał z połączenia wapnia i chloru. Powiedz, ile elektronów walencyjnych ma każdy z nich (dla pierwiastków grup 1. i 2. jest to ilość równa numerowi grupy, dla pierwiastków grup 13-18: N-10, gdzie N odpowiada numerowi grupy). Następnie przypomnij sobie, w jaki sposób tworzą się wiązania jonowe. Są to wiązania pomiędzy metalami a niemetalami. Metale oddają elektrony, przez co powstają kationy. Niemetale przyjmują elektrony, przez co powstają aniony. Wszystkie pierwiastki dążą do uzyskania oktetu elektronowego- konfiguracji stabilnej energetycznej, tożsamej z konfiguracją najbliższego gazu szlachetnego (helowca).