Oblicz ilość amoniaku jaka uległa reakcji.
0,2 mola

Przyjmij, że otrzymano 100 g mieszaniny, czyli: 25,3 g N2, 13,6 g NO oraz 100 – 25,3 – 13,6 = 61,1 g wody.
Ilość moli azotu:
1 mol – 28 g
x moli – 25,3 g
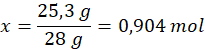
Ilość moli NO:
1 mol – 30 g
y moli – 13,6 g
![]()
Azot z amoniaku został zużyty na powstanie azotu i NO, a więc z dwóch reakcji spalania uzyskamy całkowitą ilość użytego amoniaku:
![]()
Z równania wynika, że z 4 moli amoniaku powstają 4 mole NO, a więc potrzeba 0,453 mola amoniaku, by powstało 0,453 mola NO.
![]()
Z równania wynika, że z 4 moli amoniaku powstają 2 mole azotu:
4 mole NH3 – 2 mole N2
x moli – 0,904 mola
![]()
Suma użytego NH3:
![]()
Cześć, która została zużyta na produkcję NO:
![]()

Ćwiczenie 14.1.
261Ćwiczenie 14.3.
261Ćwiczenie 14.4.
261Ćwiczenie 14.6.
261Ćwiczenie 14.7.
261Ćwiczenie 14.9.
261Ćwiczenie 14.10.
261Ćwiczenie 14.14.
262Ćwiczenie **14.25.
262Ćwiczenie 14.26.
264Ćwiczenie 14.28.
264Ćwiczenie 14.30.
264Ćwiczenie 14.31.
264Ćwiczenie 14.32.
264Ćwiczenie 14.33.
264Ćwiczenie 14.34.
264Ćwiczenie 14.35.
264Ćwiczenie 14.37.
265Ćwiczenie 14.39.
265Ćwiczenie *14.44.
265Ćwiczenie *14.51.
266Ćwiczenie 14.52.
266Ćwiczenie 14.53.
266Ćwiczenie 14.54.
266Ćwiczenie 14.57.
266Ćwiczenie 14.58.
266Ćwiczenie 14.80.
268Ćwiczenie 14.85.
268Ćwiczenie 14.86.
269Ćwiczenie 14.87.
269Ćwiczenie 14.88.
269Ćwiczenie 14.91.
269Ćwiczenie 14.93.
269Ćwiczenie 14.94.
269Ćwiczenie *14.107.
270Ćwiczenie 14.115.
271Ćwiczenie 14.116.
271Ćwiczenie 14.120.
271Ćwiczenie 14.121.
271Ćwiczenie 14.122.
271
