Zapisz równanie reakcji amoniaku z CuO.
![]()

Aby zidentyfikować trzeci produkt reakcji, należy obliczyć ile moli tego gazu w podanych warunkach zajmuje 1 dm3:
Dane:
ilość moli – ?
T – 298 K
p – 1040 hPa
V – 1 dm3
![]()
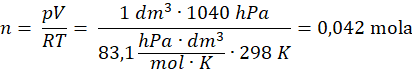
Wiadomo, że 1 dm3 (0,042 mol) ma masę 1,18 g – obliczamy masę 1 mola gazu:
0,042 mola – 1,18 g
1 mol – x g
![]()
28 g to masa molowa azotu N2.

Ćwiczenie 14.1.
261Ćwiczenie 14.3.
261Ćwiczenie 14.4.
261Ćwiczenie 14.6.
261Ćwiczenie 14.7.
261Ćwiczenie 14.9.
261Ćwiczenie 14.10.
261Ćwiczenie 14.14.
262Ćwiczenie **14.25.
262Ćwiczenie 14.26.
264Ćwiczenie 14.28.
264Ćwiczenie 14.30.
264Ćwiczenie 14.31.
264Ćwiczenie 14.32.
264Ćwiczenie 14.33.
264Ćwiczenie 14.34.
264Ćwiczenie 14.35.
264Ćwiczenie 14.37.
265Ćwiczenie 14.39.
265Ćwiczenie *14.44.
265Ćwiczenie *14.51.
266Ćwiczenie 14.52.
266Ćwiczenie 14.53.
266Ćwiczenie 14.54.
266Ćwiczenie 14.57.
266Ćwiczenie 14.58.
266Ćwiczenie 14.80.
268Ćwiczenie 14.85.
268Ćwiczenie 14.86.
269Ćwiczenie 14.87.
269Ćwiczenie 14.88.
269Ćwiczenie 14.91.
269Ćwiczenie 14.93.
269Ćwiczenie 14.94.
269Ćwiczenie *14.107.
270Ćwiczenie 14.115.
271Ćwiczenie 14.116.
271Ćwiczenie 14.120.
271Ćwiczenie 14.121.
271Ćwiczenie 14.122.
271
