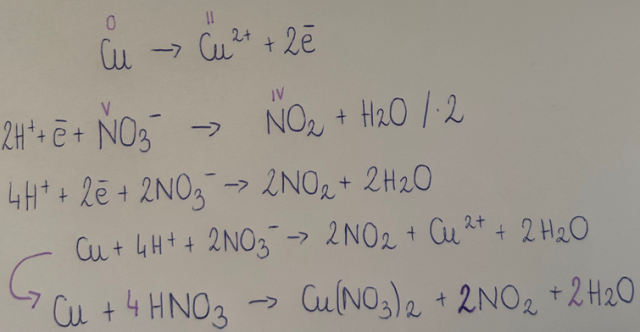I. Wydziela się brunatny gaz, blaszka miedziana ulega roztworzeniu.
II. Brak widocznych zmian.

Miedź nie reaguje z kwasem solnym, ponieważ jej potencjał elektrochemiczny, wyższy od potencjału wodoru decyduje o tym, że nie jest ona w stanie wyprzeć wodoru z roztworów kwasów beztlenowych.
Żaden pierwiastek o potencjalne elektrochemicznym dodatnim nie jest w stanie wyprzeć wodoru z roztworów jego kwasów BEZTLENOWYCH. Dla kwasów tlenowych obowiązują osobne warunki.
W reakcji ze stężonym roztworem kwasu azotowego (V) dochodzi do roztworzenia blaszki miedzianej, a z probówki wydziela się brunatny gaz jakim jest NO2. Reakcja biegnie zgodnie z równaniem: Cu + 4HNO3(stęż) à Cu(NO3)2 + 2NO2 + 2H2O.
Reakcja ta jest reakcją redoks: