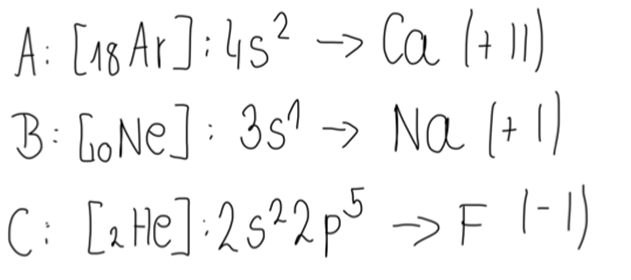

Pierwiastki dążą do uzyskania stabilnych energetycznie konfiguracji- oktetu (8 elektronów na własność na ostatniej powłoce) bądź dubletu (2 elektrony na własność na ostatniej powłoce).
Analizując konfigurację elektronową pierwiastków, należy rozważyć, do której z tych opcji bliżej jest danemu pierwiastkowi.
W opisanym przypadku wapń musiałby przyjąć 6 elektronów bądź oddać 1, co w tej sytuacji jest prostsze, zatem jego stopień utlenienia to +II.
Sód musiałby przyjąć 7 elektronów bądź oddać 1, co w tej sytuacji jest prostsze, zatem jego stopień utlenienia to +I.
Fluor musiałby przyjąć 1 elektron bądź oddać 7- lepiej jest zatem w opcji pierwszej, stąd jego stopień utlenienia to -I.