[Na+] = x
[Ca2+] = 76 mg/dm3 → 76 mg/dm3 : 40000 mg/mol = 0,0019 mol/dm3
[HCO3-] = 186 mg/dm3 → 186 mg/dm3 : 61000 mg/mol = 0,003 mol/dm3
[SO42-] = 68 mg/dm3 → 68 mg/dm3 : 96000 mg/mol = 0,0007 mol/dm3
x = (0,003 + 2 ∙ 0,0007) - (2 ∙ 0,0019) = 0,0044 - 0,0038 = 0,0006 = 6 ∙ 10-4 [mol/dm3]
Odpowiedź: Stężenie molowe kationów sodu w badanej wodzie to 6 ∙ 10-4 mol/dm3.

Krok 1: Zobacz, jakie mogą się tworzyć sole: CaSO4, NaHCO3 i CaCO3. Mamy dane informacje o stężeniu Ca2+, HCO3- i SO42-.
Krok 2: Obliczamy masy molowe jonów. Masy poszczególnych atomów znajdziesz w tabeli pierwiastków chemicznych.
mCa2+ = 40 g/mol = 40000 mg/mol
mHCO3- = 1 + 12 + 3 ∙ 16 = 61 [g/mol] = 61000 mg/mol
mSO42- = 32 + 4 ∙ 16 = 96 [g/mol] = 96000 mg/mol
Jednostki skrócą się w następujący sposób:
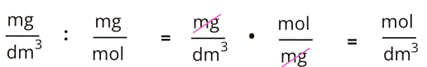
Krok 3: Przeliczamy stężenia w mg/dm3 na mol/dm3, ponieważ molowo w wodzie musi być tyle samo kationów, co anionów. Przeliczamy to według wzoru:
stężenie w mg/dm3 : masa molowa w mg/mol = stężenie w mol/dm3
[Ca2+] = 76 mg/dm3 → 76 mg/dm3 : 40000 mg/mol = 0,0019 mol/dm3
[HCO3-] = 186 mg/dm3 → 186 mg/dm3 : 61000 mg/mol = 0,003 mol/dm3
[SO42-] = 68 mg/dm3 → 68 mg/dm3 : 96000 mg/mol = 0,0007 mol/dm3
Krok 4: Od ładunków ujemnych odejmujemy ładunki dodatnie. Wynik będzie stężeniem jonów Na+.
x = ładunki ujemne - ładunki dodatnie = (0,003 + 2 ∙ 0,0007) - (2 ∙ 0,0019) = 0,0044 - 0,0038 = 0,0006 = 6 ∙ 10-4 [mol/dm3]