NO, CO2, CO, HCl

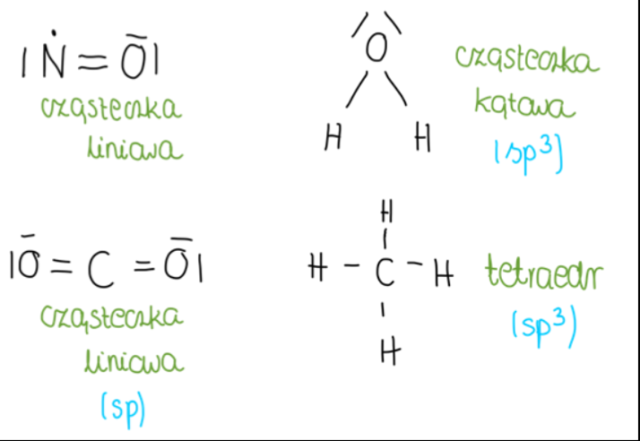

Aby ustalić hybrydyzację atomu, należy policzyć liczbę tworzonych przez niego wiązań sigma i dodać do niej liczbę wolnych par elektronowych na tym atomie. W przypadku węglowodorów, na atomie węgla nigdy nie ma wolnych par elektronowych, zatem o hybrydyzacji decydują wyłącznie wiązania sigma.
Jeśli suma ta wynosi 2, mamy do czynienia z hybrydyzacją sp, 3- sp2, 4- sp3.
Z hybrydyzacji wynika kształt cząsteczki:
| Rodzaj hybrydyzacji | Liczba wiązań s tworzonych przez atom centralny | Liczba wolnych par elektronowych na atomie centralnym | Kształt cząsteczki |
| sp | 2 | 0 | liniowa |
| sp2 | 3 | 0 | trójkątna |
| 2 | 1 | cząsteczka kątowa | |
| sp3 | 4 | 0 | tetraedr |
| 3 | 1 | piramida trygonalna | |
| 2 | 2 | cząsteczka kątowa |
Wyjątek stanowią tu cząsteczki składające się z dwóch moli atomów, takie jak NO, HCl i CO, ponieważ muszą mieć one budowę liniową.