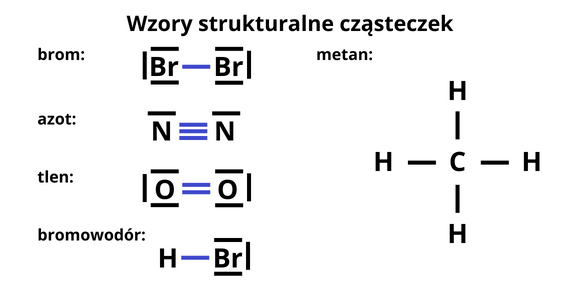

Najlepiej zacząć od narysowania przy atomie pierwiastka jego elektronów walencyjnych, para elektronowa tworzy kreskę.
Następnie określić elektroujemność każdego pierwiastka i zastanowić się jaki typ wiązania powstanie.
Elektroujemność odczytaj z układu okresowego zawierającego elektroujemność dla każdego pierwiastka.
Elektroujemność bromu = 2,8
Elektroujemność wodoru = 2,1
Elektroujemność tlenu = 3,5
Elektroujemność wapnia = 1,0
Elektroujemność potasu = 0,9
Elektroujemność azotu = 3,0
Elektroujemność węgla = 2,5
Elektroujemność sodu = 0,9
Elektroujemność cezu = 0,7
Elektroujemność jodu = 2,5
Elektroujemność fosforu = 2,1
Elektroujemność chloru = 3,0
Wiązanie kowalencyjne niespolaryzowane <0,4 różnica elektroujemności
Wiązanie kowalencyjne spolaryzowane 0,4−1,7 różnica elektroujemności
Wiązanie jonowe > 1,7 różnica elektroujemności
Wiedząc jaki typ wiązania powstanie piszesz wzór strukturalny cząsteczki, zaznaczając rodzaj wiązania między atomami pierwiastków.