1. F
2. P
3. F/P
4. P
5. F
6. F

Dotyczy zdania 1.:
· Promień to odległość elektronów położonych najdalej od jądra.
· Promienie kationów są zawsze najmniejsze. Promienie anionów są zawsze największe. Pośrednią długość wykazują promienie atomów macierzystych w stanie podstawowym.
· W obrębie grupy im wyższa liczba atomowa, tym dłuższy promień, ponieważ rośnie liczba powłok, na których rozmieszczone są elektrony, a co za tym idzie- odległość najdalej położonego od jądra elektronu.
· W obrębie okresu im wyższa liczba atomowa, tym krótszy promień, ponieważ wraz ze wzrostem ładunku jądra, rośnie siła przyciągania elektronów przez to jądro, co skraca promień.
Dotyczy zdania 2.:
· Aby udowodnić odczyn roztworu soli, należy przeprowadzić jej reakcję z wodą- jest to tzw. reakcja hydrolizy.
· Jeśli w reakcji, w produktach wyodrębniają się jony H+, to roztwór ten ma odczyn kwasowy, a hydrolizę taką nazywamy kationową. Dotyczy ona soli mocnego kwasu i słabej zasady.
· Jeśli w reakcji, w produktach wyodrębniają się jony OH-, to roztwór ten ma odczyn zasadowy, a hydrolizę taką nazywamy anionową. Dotyczy ona soli słabego kwasu i mocnej zasady.
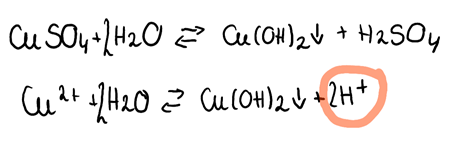
Dotyczy zdania 3.:
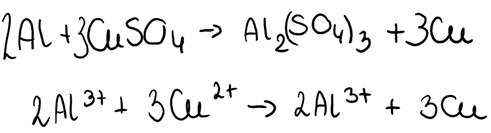
W zadaniu nie jest sprecyzowane, czy roztwór kwasu jest zimny czy gorący, zatem nie można ocenić prawdziwości zdania. Reakcje wyglądałyby w następujący sposób:
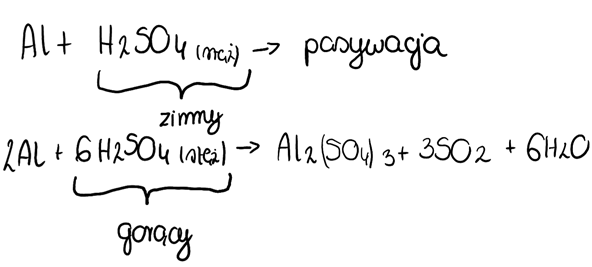
Dotyczy zdania 4.:

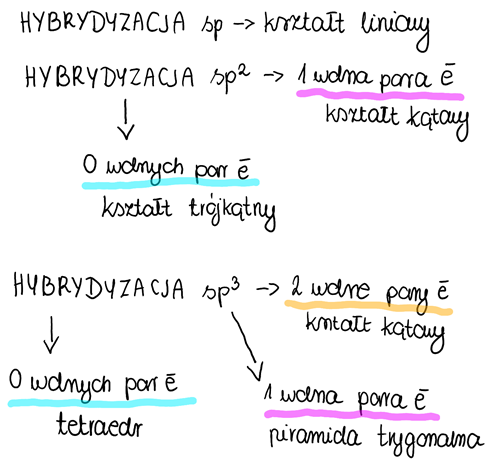
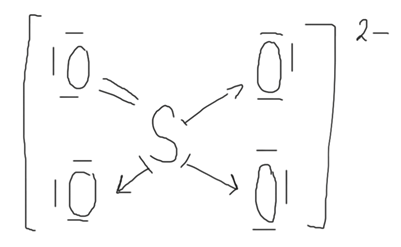
Dotyczy zdania 5.:
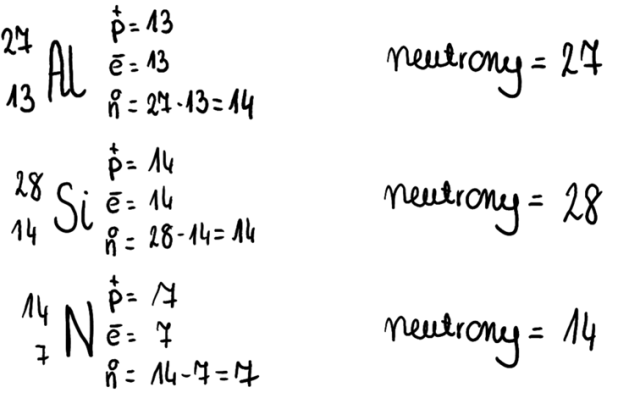
![]() à A- liczba masowa; Z- liczba atomowa; X- symbol pierwiastka
à A- liczba masowa; Z- liczba atomowa; X- symbol pierwiastka
· Izotopy- nuklidy tego samego pierwiastka, różniące się liczbą neutronów w jądrze, a co za tym idzie- liczbą masową.
· Izotony- nuklidy pierwiastków mające taką samą liczbę neutronów.
· Izobary- nuklidy pierwiastków o identycznej liczbie nukleonów.
Dotyczy zdania 6.:
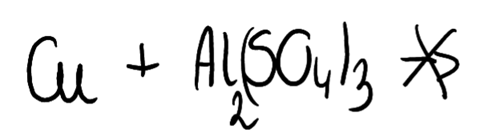
Aby porównać aktywność pierwiastków, należy skorzystać z szeregu elektrochemicznego metali.
Im niższy potencjał standardowy, tym większa aktywność pierwiastka. Mniej aktywny pierwiastek nie wyprze bardziej aktywnego z roztworu jego kwasu czy soli.