

Krok 1: Zapisz dane. Informację o stężeniu uzyskujemy z treści zadania, a stała dysocjacji (K) dla kwasu mrówkowego jest dostępna w tablicach maturalnych.
C = 0,1 mol/dm3
K = 1,78 ∙ 10-4
Krok 2: Zastanów się, czym jest pH. Jest to wartość równa ujemnemu logarytmowi ze stężenia jonów wodorowych. Stężenie jonów H+ dostępne jest we wzorze na stałą dysocjacji (α):
α = [H+] : C, czyli [H+] = α ∙ C
Do użycia wzoru brakuje nam również wartości stałej dysocjacji. Obliczamy ją ze wzoru:
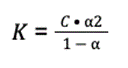
Według prawa rozcieńczeń Ostwalda, gdy iloraz stężenia i stałej dysocjacji K jest większy niż 400, można skorzystać ze wzoru uproszczonego na K i pominąć mianownik równania:
![]()
Korzystamy z pełnego wzoru i rozwiązujemy równanie:
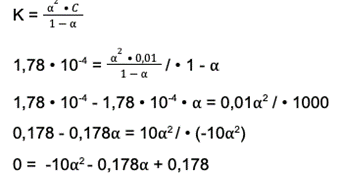
Krok 3: Liczymy deltę. Wzór na deltę to:
Δ = b2 – 4ac, gdzie:
a = -10, b = -0,178, c = 0,178
Dane podstawiamy do wzoru:
Δ = b2 – 4ac = (-0,178)2 – 4 ∙ (-10) ∙ 0,178 = 0,032 + 7,12 = 7,52
Krok 4: Do wyliczenia wartości alfa niezbędny nam jest pierwiastek z delty, czyli pierwiastek z 7,52 = 2,67
Uzupełniamy wzory na dwie wartości alfa. Pamiętaj, że wartość ta nie może być mniejsza niż zero.
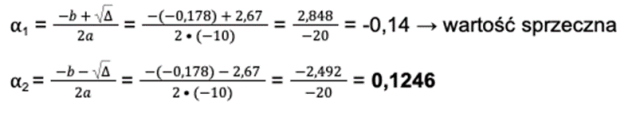
Krok 5: Mamy dostępną wartość stopnia dysocjacji i stężenie. Wracamy do początku punktu drugiego i rozwiązujemy równanie:
[H+] = α ∙ C = 0,1246 ∙ 0,01 = 1,246 ∙ 10-3 [mol/dm3]
Krok 4: Wartość stężenia jonów wodorowych podstawiamy do wzoru na pH.
pH = -log[H+] = -log(1,246 ∙ 10-3) = 2,9