100% – 77,7% – 7,5% = 14,8%
mO = 16 g/mol
mC = 12 g/mol
16 g — 14,8%
x — 77,7%
x = 16 ∙ 77,7 : 14,8 = 84 [g] → 84 g : 12 g = 7 (ilość atomów węgla)
mH = 1 g/mol
16 g — 14,8%
y — 7,5%
y = 7,5 ∙ 16 : 14,8 = 8,11 ≈ 8 [g] → 8 g : 1 g = 8 (ilość atomów wodoru)
Wzór sumaryczny: C7H8O
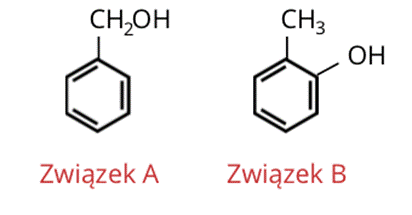
Wzory półstrukturalne:

Krok 1: Oblicz zawartość tlenu w związku.
%O = 100% – %C – %H = 100% – 77,7% – 7,5% = 14,8%
Krok 2: Kwasy karboksylowe powstają w wyniku utleniania silnymi utleniaczami (takimi jak KMnO4 w środowisku kwasowym) alkoholi. Wiemy, że powstały kwasy monokarboksylowe, więc musiały powstać z alkoholi monohydroksylowych (z jedną grupą -OH). Zatem w związku jest jeden atom tlenu o masie 16 g/mol. Na tej podstawie liczymy ilość atomów węgla i wodoru w związkach.
mO = 16 g/mol
mC = 12 g/mol
16 g — 14,8%
x — 77,7%
x = 16 ∙ 77,7 : 14,8 = 84 [g] → 84 g : 12 g = 7 (ilość atomów węgla)
mH = 1 g/mol
16 g — 14,8%
y — 7,5%
y = 7,5 ∙ 16 : 14,8 = 8,11 ≈ 8 [g] → 8 g : 1 g = 8 (ilość atomów wodoru)
Krok 3: Związki mają wzór sumaryczny C7H8O. Z treści wiadomo, że są to związki aromatyczne. Wzór sumaryczny pierścienia aromatycznego to C6H6. Do dyspozycji zostaje jeden atom węgla, jeden atom tlenu i trzy atomy wodoru (podstawniki zabierają atom wodoru z pierścienia). Zatem podstawnik musi mieć jeden atom węgla, trzy atomy wodoru i jeden atom tlenu. Związkiem A jest benzenol.
Wiemy, że kwas D ma w pozycji orto podstawnik funkcyjny (-OH). Więc drugi podstawnik stanowi grupa metylowa. Związkiem B jest 2-metylofenol.