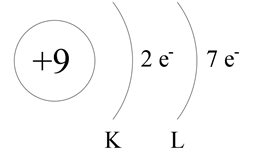

Fluor ma liczbę atomową równą 9 – jest to liczba protonów w jądrze (wpisz ją w okręgu symbolizującym jądro atomowe). Znajduje się w drugim okresie, ma zatem dwie powłoki elektronowe (podpisane literami K i L). Fluor jest pierwiastkiem grupy siedemnastej, ma zatem siedem elektronów walencyjnych (w grupach 13 -18 liczba elektronów walencyjnych wynosi
![]() , gdzie N to numer grupy; elektrony walencyjne to elektrony z ostatniej powłoki). Liczbę elektronów na pozostałych powłokach możesz obliczyć stosując wzór:
, gdzie N to numer grupy; elektrony walencyjne to elektrony z ostatniej powłoki). Liczbę elektronów na pozostałych powłokach możesz obliczyć stosując wzór:
![]() , gdzie n to numer powłoki. Dla powłoki K mamy więc:
, gdzie n to numer powłoki. Dla powłoki K mamy więc:
![]() . Jako, że jest to nie tylko pierwsza, ale i przedostatnia powłoka, liczbę elektronów na niej możesz obliczyć również odejmując od wszystkich elektronów (których liczba równa jest liczbie protonów) elektrony walencyjne:
. Jako, że jest to nie tylko pierwsza, ale i przedostatnia powłoka, liczbę elektronów na niej możesz obliczyć również odejmując od wszystkich elektronów (których liczba równa jest liczbie protonów) elektrony walencyjne:
![]()
Uwaga: Zastanawiasz się w jaki sposób nadać nazwy powłokom walencyjnym? Istnieje siedem powłok, których nazwy to K, L, M, N, O, P i Q. Kiedy sprawdzisz, w którym okresie znajduje się pierwiastek, a więc ile ma powłok, nadajesz im nazwy literami po kolei, rozpoczynając od K.