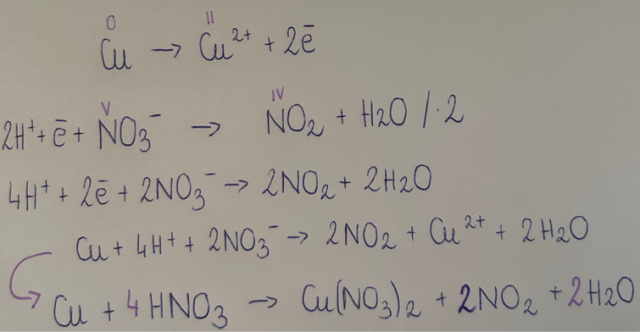I. Cu + HCl à reakcja nie zachodzi
II. Cu + 2H2SO4(stęż.) à CuSO4 + SO2 + 2H2O
III. Cu + 2AgNO3àCu(NO3)2 + 2Ag
IV. Cu + 4HNO3(stęż.) à Cu(NO3)2 + 2NO2 + 2H2O

I. Miedź nie reaguje z kwasem solnym, gdyż jej potencjał elektrochemiczny, wyższy od potencjału wodoru decyduje o tym, że nie jest ona w stanie wyprzeć wodoru z roztworów kwasów beztlenowych.
II. W reakcji wydziela się bezbarwny gaz o charakterystycznym, duszącym zapachu.
III. Miedź jest metalem aktywniejszym od srebra (ma niższy potencjał elektrochemiczny od srebra), w związku z czym może wypierać ten metal z roztworów jego soli.
IV. Reakcja ta jest reakcją redoks: