Obie substancje znajdują się w tych samych warunkach ciśnienia i temperatury, więc można przyjąć, że ich objętości będą wprost proporcjonalne do liczby moli gazu.
Zakładamy, że dla gazów w tych samych warunkach, ich objętości będą takie same (10 dm³ w obu przypadkach).
Obliczymy masy gazów, bazując na ich masach molowych i liczbie moli w danej objętości.
1. Obliczanie masy powietrza
Powietrze jest mieszaniną gazów, ale dla uproszczenia przyjmiemy, że jego średnia masa molowa wynosi 29 g/mol.
Zgodnie z teorią gazów doskonałych 1 mol gazu w warunkach normalnych (ciśnienie 1013 hPa, temperatura 273 K) zajmuje objętość 22,4 dm³.Stąd, dla objętości 10 dm³ powietrza, liczba moli powietrza wynosi:
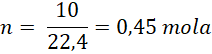
Masa powietrza w tej objętości będzie wynosiła:
![]()
2. Obliczanie masy helu
Masa molowa helu MHe = 4 g/mol.
Zgodnie z teorią gazów doskonałych, dla 10 dm³ helu liczba molihelu wynosi:
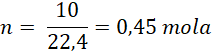
Masa helu w tej objętości będzie wynosiła:
![]()
3. Porównanie mas
Porównanie masy helu i powietrza w tych samych warunkach:
![]()
