
Reakcja dysproporcjonowania to reakcja redoks, w której ten sam pierwiastek chemiczny jednocześnie ulega utlenieniu i redukcji. Oznacza to, że w jednym procesie część atomów danego pierwiastka zwiększa swój stopień utlenienia, a część go zmniejsza, tworząc różne produkty.
Reakcja synproporcjonowania to reakcja redoks odwrotna do dysproporcjonowania. Polega na tym, że ten sam pierwiastek występujący w dwóch różnych stopniach utlenienia reaguje ze sobą, a w wyniku reakcji powstaje związek, w którym pierwiastek ma pośredni stopień utlenienia.
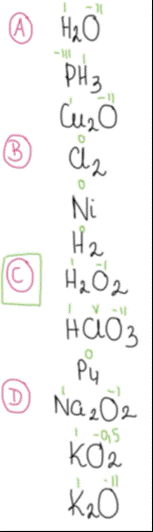
W przypadku podpunktu C, tlen w nadtlenku wodoru może się utlenić do stopnia utlenienia 0 i zredukować do -II, chlor w kwasie chlorowym (V) może się zredukować do chloru na -I, 0, I, III stopnia utlenienia, a utlenić do stopnia +VII, zaś fosfor może się zredukować do stopnia -III lub utlenić do stopni III, V.