
Reakcja dysproporcjonowania to reakcja redoks, w której ten sam pierwiastek chemiczny jednocześnie ulega utlenieniu i redukcji. Oznacza to, że w jednym procesie część atomów danego pierwiastka zwiększa swój stopień utlenienia, a część go zmniejsza, tworząc różne produkty.
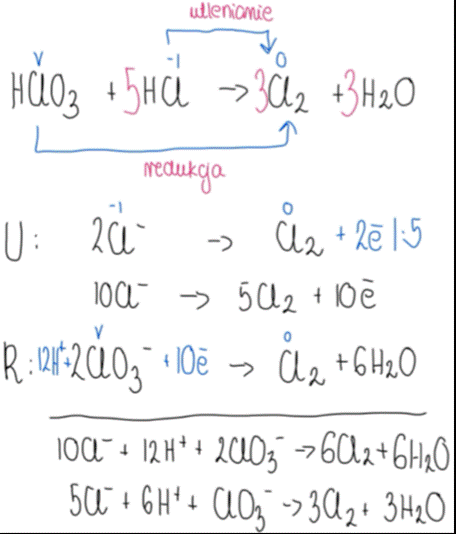
Reakcja synproporcjonowania to reakcja redoks odwrotna do dysproporcjonowania. Polega na tym, że ten sam pierwiastek występujący w dwóch różnych stopniach utlenienia reaguje ze sobą, a w wyniku reakcji powstaje związek, w którym pierwiastek ma pośredni stopień utlenienia.
Suma stopni utlenienia w związku chemicznym musi być równa 0, a w jonie- równa jego ładunkowi.
W większości związków tlen występuje na -II stopniu utlenienia, z wyjątkiem nadtlenków (-I) i ponadtlenków (-0,5).
W większości związków wodór występuje na +I stopniu utlenienia, a pierwiastki I i II grupy układu okresowego mają jeden, stały stopień utlenienia, równy numerowi grupy. Stały stopień utlenienia mają także glin (+III) oraz cynk (+II).
Pierwiastki w stanie wolnym (w przypadku gazów cząsteczki również traktujemy jako stan wolny)- stopień utlenienia równy 0.