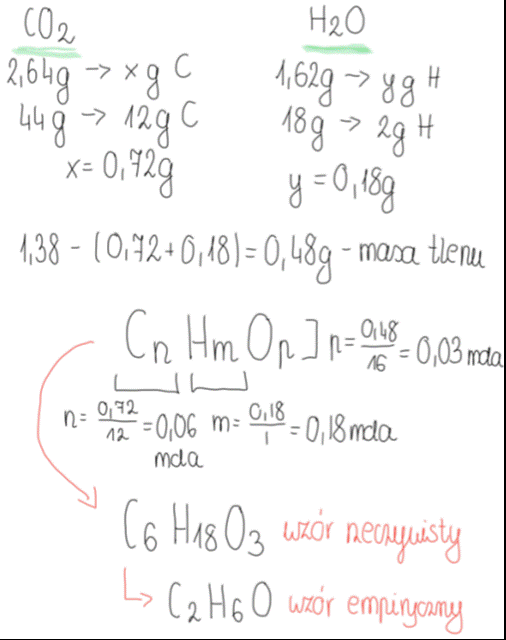

1. Obliczamy zawartość węgla w zadanej porcji CO2, jako referencję stosując dane dotyczące 1 mola tego związku, tj. masę molową równą 44 g/mol, a w jednym molu dwutlenku węgla znajduje się 12g węgla.
2. Obliczamy zawartość wodoru w zadanej porcji H2O, jako referencję stosując dane dotyczące 1 mola tego związku, tj. masę molową równą 18 g/mol, a w jednym molu wody znajdują się 2g wodoru.
3. Od całkowitej masy związku odejmujemy wyliczone masy węgla i wodoru, a pozostała masa świadczy o obecności trzeciego pierwiastka we wzorze związku- tlenu.
4. Wyliczone masy pierwiastków dzielimy przez ich masy molowe, otrzymując stosunek molowy pierwiastków.
5. Obliczony wzór rzeczywisty (pełny) przekształcamy we wzór empiryczny, dzieląc ilości moli przez największy wspólny dzielnik, jakim jest 3. Wzór empiryczny to wzór związku po jego maksymalnym uproszczeniu.