| Kwas węglowy | Kwas azotowy(V) | Kwas fosforowy(V) | |
| Wzór sumaryczny | H2CO3 | HNO3 | H3PO4 |
| Wartościowość reszty kwasowej | II | I | III |
| Wartościowość niemetalu | IV | V | V |
| Model budowy |
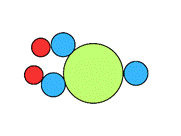
|
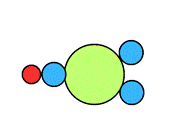
|
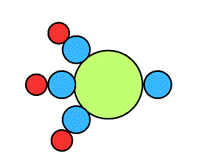
|
| Równanie reakcji jego otrzymywania | CO2 + H2 | N2O5 + H2 | P4O10 + 6 H2 |
| Zastosowanie kwasu | Produkcja napojów gazowanych | Produkcja materiałów wybuchowych | Produkcja nawozów sztucznych |
| Równanie dotyczące dysocjacji elektrolitycznej | H2CO3
| HNO3
| H3PO4
|

Reszta kwasowa fragment cząsteczki kwasu powstałego po oderwaniu się od kwasu w wyniku dysocjacji jednego lub większej ilości kationów wodoru – mając kwas siarkowy(VI) – H2SO4, resztą kwasową jest anion siarczanowy(VI) o wzorze SO42–
Dysocjacja stopniowa polega na kolejnym odłączaniu protonów w kwasach lub kolejnym odłączaniu grupy wodorotlenowej w zasadach.
Na przykładzie siarkowodoru przeanalizujemy dysocjację stopniową. W pierwszym kroku z kwasu odszczepia nam się jeden proton i w produktach mamy: wspomniany jon wodoru i jon. HS-W drugim kroku dysocjuje jon HS- i w produktach mamy jon wodoru i jon S2-.
Obliczanie wartościowości niemetalu na przykładzie HCl:
1. Mnożymy wartościowość tlenu przez ilość jego atomów w cząsteczce:
2 · 1 = 2
2. Od wyniku odejmujemy ilość atomów wodoru w cząsteczce kwasu.
2 – 1 = 1
Odpowiedź: Wartościowość niemetalu w tym kwasie wynosi I.
Wartościowość reszty kwasowej jest równa ilości wodoru w cząsteczce kwasu.