Napisz symbole chemiczne pierwiastków E1 i E2, numery grup i symbole bloku
konfiguracyjnego, do którego należą.
E1 – 6 elektronów walencyjnych, 5 okres: Te, grupa 16, blok konfiguracyjny: p.
E2 – 6 elektronów walencyjnych, 5 okres: Mo, grupa 6, blok konfiguracyjny: d.
Napisz pełną konfigurację elektronową obydwu pierwiastków chemicznych w stanie podstawowym, stosując schemat klatkowy oraz konfigurację skróconą. Podaj numery powłok elektronowych oraz symbole podpowłok elektronowych.
Konfiguracja elektronowa telluru:

Te: [Kr] 5s25p4
Numer powłoki elektronowej: 5,
Symbol powłoki elektronowej: O,
Symbol podpowłoki: p.
Konfiguracja elektronowa molibdenu:
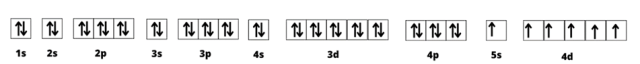
Te: [Kr] 5s15d5
Numer powłoki elektronowej: 5,
Symbol powłoki elektronowej: O,
Symbol podpowłoki: d.
Uzasadnij odpowiednią regułą liczbę elektronów niesparowanych w ostatniej powłoce
elektronowej obydwu pierwiastków chemicznych – reguła niesparowanych elektronów odnosi się do reguły Hunda, które mówi o tym, że w atomie istnieje możliwie największa liczba niesparowanych elektronów.

Symbole powłok elektronowych: K, L, M, N, O, P, Q.
Na podstawie konfiguracji elektronowej pierwiastka chemicznego możemy określić liczbę elektronów. Wiemy, że liczba elektronów jest równa liczbie protonów, czyli liczbie atomowej Z. Na podstawie liczby atomowej Z możemy określić położenie pierwiastka chemicznego w układzie okresowym pierwiastków chemicznych.