- wzór elektronowy i kreskowy cząsteczek bromowodoru HBr:
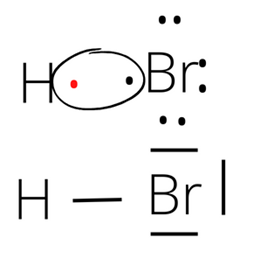
- wzór elektronowy i kreskowy cząsteczek siarkowodoru H2S:
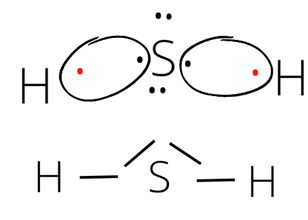

∆EH2S = 2,5 – 2,1 = 0,4
∆EHCl = 3,0 – 2,1 = 0,9
- wiązanie kowalencyjne – wiązanie pomiędzy niemetalami, które uwspólniają swoje elektrony walencyjne. Wyróżniamy dwa rodzaje:
a) wiązanie kowalencyjne niespolaryzowane – pomiędzy dwoma tymi samymi pierwiastkami (H2, Cl2, Br2).
∆E = 0.
- wiązanie kowalencyjne spolaryzowane – pomiędzy dwoma różnymi niemetalami, np. HCl, HBr, HJ, H2S
∆E = zakres od 0,4 do 1,7.