H3O+
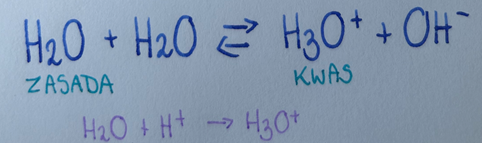

Zgodnie z teorią Bronsteda-Lowry’egokwas to dawca (donor) protonu (H+)- każde indywiduum chemiczne, które w reakcji chemicznej może oddać kation wodoru, a zasada Bronsteda-Lowry’ego- biorca (akceptor) protonu (H+)- każde indywiduum chemiczne, które w reakcji może przyjąć kation wodoru.
Przykład reakcji kwas-zasada Bronsteda-Lowry’ego:
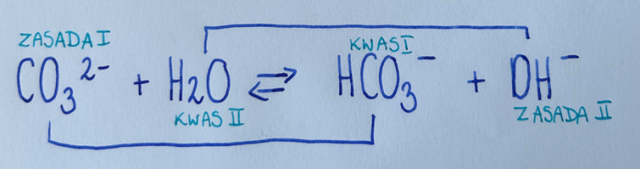
W parze oznaczonej numerem I jon CO32- nie dysponuje żadnym protonem, zatem jest zasadą- bo może jedynie kation przyjąć (tworząc jon HCO3-), a jon HCO3- jest kwasem, bo dysponuje protonem, który może oddać z wytworzeniem jonu CO32-.
W parze oznaczonej numerem II H2O jest kwasem, bo dysponuje protonem, który może oddać z wytworzeniem jonu OH-. Jon OH- jest zasadą, bo nie dysponuje żadnym protonem, a może go jedynie przyjąć (tworzy się wówczas cząsteczka wody).
Aby udowodnić, która z molekuł jest kwasem, a która zasadą wedle tej teorii, zwykle należy przeprowadzić reakcję z wodą.