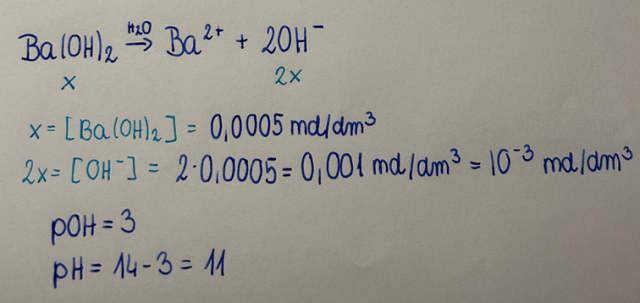

1. Zapisujemy równanie reakcji dysocjacji mocnej zasady, aby wiedzieć, jaki jest stosunek molowy całości zasady do anionów wodorotlenkowych- w przypadku elektrolitów mocnych należy przyjąć pewnego rodzaju przybliżenie- jeśli stosunek molowy zasady i anionów wodorotlenkowych jest jak 1:2 (w opisanym przypadku x:2x), to stężenie OH- jest 2x większe od stężenia całkowitego zasady.
2. Stężenie anionów wodorotlenkowych najlepiej przedstawić w postaci notacji wykładniczej.
3. Wyznaczamy wartość pOH jako ujemnego logarytmu ze stężenia jonów wodorotlenkowych, a prościej- w postaci dodatniej potęgi dziesiątki z notacji wykładniczej, a następnie pH, zgodnie z zależnością
![]() .
.