Pb2+ + 2 Cl-→ PbCl2
KSO = 1,7 ∙ 10-5
KSO = [Pb2+] ∙ [Cl-]2
[Pb2+] = x
[Cl-] = 2x
1,7 ∙ 10-5 = x ∙ (2x)2
1,7 ∙ 10-5 = x ∙ 4x2
1,7 ∙ 10-5 = 4x3 / : 4
x3 = 1,7 ∙ 10-5
x3 =
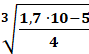 = 0,016 [
= 0,016 [
![]() ]
]
Odpowiedź: Stężenie molowe nasyconego roztworu PbCl2 wynosi 0,016
![]() .
.
