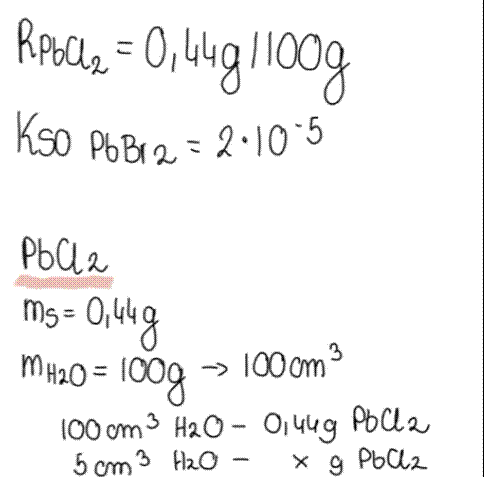
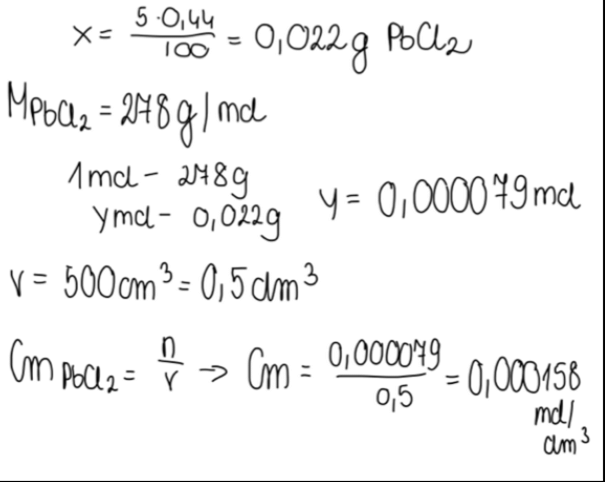
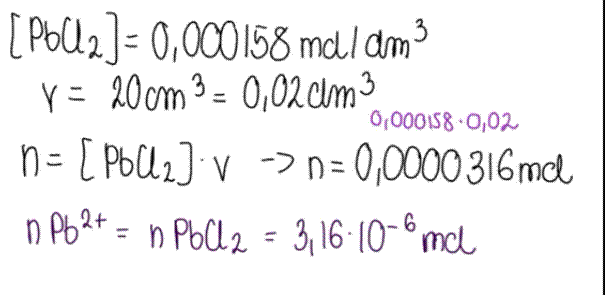

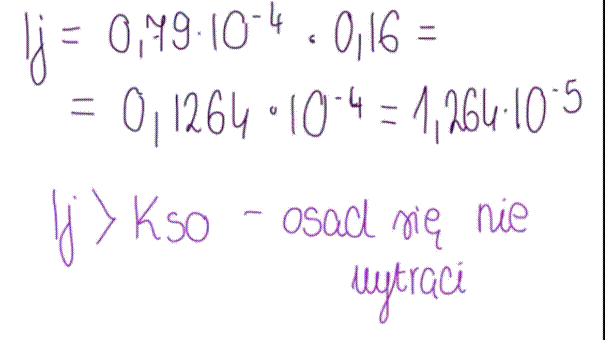

Gęstość wody wynosi 1 g/cm3, zatem 100g wody zajmuje objętość 100cm3.
Iloczyn rozpuszczalności jest wielkością opisującą równowagę między trudno rozpuszczalną solą a jej jonami w roztworze wodnym. Dotyczy on substancji, które tylko częściowo ulegają dysocjacji w wodzie, tworząc roztwory nasycone. W stanie równowagi pomiędzy osadem a jonami w roztworze zachodzi proces rozpuszczania i wytrącania o jednakowej szybkości.
Dla soli trudno rozpuszczalnej o wzorze ogólnym AₓBᵧ, która w wodzie dysocjuje według równania: AxBy⇄ xAy+ + yBx-, iloczyn rozpuszczalności zapisuje się jako iloczyn stężeń jonów podniesionych do odpowiednich potęg: Kₛ = [Ay+]x · [Bx-]ʸ.
Wartość iloczynu rozpuszczalności jest stała w danej temperaturze i zależy od rodzaju substancji.
Na podstawie iloczynu rozpuszczalności można określić warunek wytrącania osadu. Jeżeli iloczyn stężeń jonów w roztworze, nazywany iloczynem jonowym, jest mniejszy od wartości Kₛ, sól może się jeszcze rozpuszczać i osad nie powstaje. Gdy iloczyn jonowy jest równy Kₛ, roztwór jest nasycony i pozostaje w stanie równowagi. Natomiast gdy iloczyn jonowy przekracza wartość Kₛ, spełniony jest warunek wytrącania osadu i następuje jego powstawanie.