Wzór anionu w nadtlenku sodu:
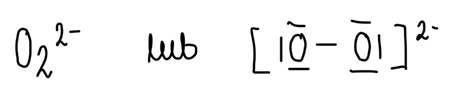
Wzór anionu w tlenku sodu:


We wzorach elektronowych uwzględniamy jedynie elektrony walencyjne danego pierwiastka, ponieważ wyłącznie one uczestniczą w tworzeniu wiązań chemicznych.
Ich ilość jest równa numerowi grupy dla pierwiastków zlokalizowanych w grupach 1-12, zaś dla pierwiastków z grup 13-18 liczba elektronów jest równa x-10, gdzie x to numer grupy, w której leży dany pierwiastek.
Pierwiastki dążą do tego, aby ostatnia powłoka była zapełniona kompletem 8 elektronów- wówczas uzyskają konfigurację najbliższego helowca, spełniającą regułę oktetu. Jest to konfiguracja stabilna i korzystna energetycznie dla atomu.